
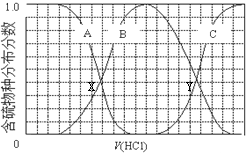
| A. | 含硫物种B表示HS- | |
| B. | 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] | |
| C. | X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值 | |
| D. | NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-═CuS↓+H+ |
分析 A.向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;
B.NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系;
C.B为HS-,C表示H2S,当滴加盐酸至Y点时,表示两者含量相等,所以Ka=$\frac{c(H{S}^{-})c({H}^{+})}{c({H}_{2}S)}$;
D.NaHS溶液中加入CuSO4溶液,会发生反应生成硫化铜和酸;
解答 解:A.向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,
故A正确;
B.C浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或溶液中存在电荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
故B正确;
C.图象分析可知A为S2-,B为HS-,C表示H2S,当滴加盐酸至Y点时,表示两者含量相等,所以Ka=$\frac{c(H{S}^{-})c({H}^{+})}{c({H}_{2}S)}$=c(H+),X点为S2-和HS-浓度相同,可以计算HS-的电离平衡常数,不能计算H2S的第一步电离平衡常数,故C错误;
D.NaHS溶液中加入CuSO4溶液,硫化铜难溶于稀酸会发生反应Cu2++HS-=CuS↓+H+,溶液显示强酸性,故D正确;
故选C.
点评 本题考查了图象变化和反应定量关系的分析判断,主要是弱电解质电离平衡、电离平衡常数计算、物质性质和反应产物的理解应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
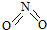 和
和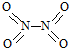 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子分离膜 | B. | 隐形眼镜 | C. | 人造丝 | D. | 人造骨酪 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
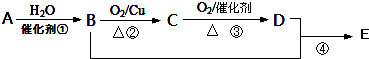
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
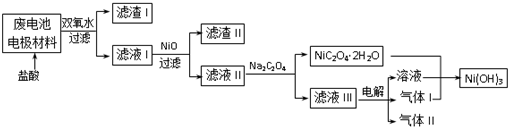
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或事实 | 主要原因 | |
| A | 燃煤中添加适量CaO可减少SO2排放量 | 燃烧中硫元素转化为CaSO3 |
| B | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| C | 夏天雷雨过后感觉到空气特别的清新 | 空气中O3含量增加、尘埃减少 |
| D | 蒸熟的糯米在适当条件可转化为香甜可口的甜酒 | 部分淀粉水解生成葡萄糖与乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
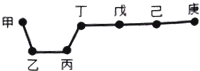 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲与己形成的化合物一定是离子化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com