

| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
分析 (1)设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和计算;
(2)①已知4分钟时氮气为2.5mol,根据v(N2)=$\frac{△c}{△t}$计算;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.催化剂改变反应速率不改变化学平衡;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)向某密闭容器中加入一定量的活性炭和NO,反应生成氮气和二氧化碳;
①根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质;
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,对平衡来说相当于增大压强,反应前后气体体积不变,压强增大平衡不变,达新平衡时NO的体积分数不变;
③根据浓度比值的变化来确定移动方向,结合三行计算列式计算.
解答 解:(1)设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和,-462=6x+3×243-(945+6y),x-y=41kJ,
故答案为:41;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=$\frac{△c}{△t}$=$\frac{\frac{2.5mol}{2L}}{4min}$=0.3125mol•L-1•min-1,
故答案为:0.3125mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,故答案为:分离出了二氧化碳;
②向某密闭容器中加入一定量的活性炭和NO,反应生成氮气和二氧化碳,反应的化学方程式为:C+2NO?N2+CO2,加入NO反应正向进行,对平衡来说相当于增大压强,反应前后气体体积不变,压强增大平衡不变,达新平衡时NO的体积分数不变,
故答案为:正反应方向;等于;
③30min时,容器中NO、N2、CO2的浓度之比=0.040:0.030:0.030=4:3:3,30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则平衡向逆反应方向移动,所以逆反应是吸热反应,正反应是放热反应,则△H<0,从反应开始到T2℃平衡时设平衡浓度为5x、3x、3x,反应前后气体物质的量不变得到:5x+3x+3x=0.1,x=$\frac{0.1}{11}$,
C+2NO?N2+CO2,
起始量(mol/L) 0.1 0 0
变化量(mol/L) 0.1-$\frac{0.5}{11}$ $\frac{0.3}{11}$ $\frac{0.3}{11}$
平衡量(mol/L) $\frac{0.5}{11}$ $\frac{0.3}{11}$ $\frac{0.3}{11}$
NO转化率=$\frac{0.1-\frac{0.5}{11}}{0.1}$×100%=54.5%,
故答案为:<;54.5%.
点评 本题考查了反应焓变和键能的计算关系、化学平衡影响因素、化学平衡化学反应速率计算、掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 分子数为 3.01×1023个的SO2 | B. | 0.48 molH2SO4 | ||
| C. | 标准状况下8.96L CH4 | D. | 9g 氖气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2和10g O2 | B. | 11.2L(标准状况)H2O和0.5mol Br2 | ||
| C. | 5.6L N2(标准状况)和11g CO2 | D. | 224mL H2(标准状况)和0.1mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 可用YO2+Z2+2H2O=H2YO4+2HZ,证明非金属性:Z>Y | |
| B. | 含有Z元素的钠盐溶液都呈中性 | |
| C. | 由非金属性Z>Y可知,最高价氧化物对应的水化物的氧化性:Z>Y | |
| D. | 最简单气态氢化物的热稳定性:R>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应阶段 | 溶液中的存在的金属离子 | 残留的金属粉末 | 发生的离子反应 |
| 第一阶段 | 只有一种 | 有两种 | (1) |
| 第二阶段 | 只有一种 | 只有一种 | |
| 第三阶段 | 只有两种 | (2) | (3) |
| 笫四阶段 | 有三种 | (4) | |
| 笫五阶段 | (5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
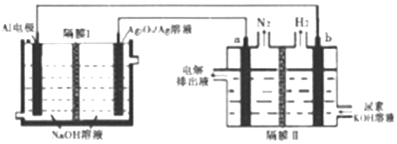
| A. | Ag电极是正极,反应后该电极区溶液pH减小 | |
| B. | 原电池的总反应为:2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O | |
| C. | a电极上的电极反应为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O | |
| D. | 每消耗2.7g铝,理论上a、b两级共产生气体3.36L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的摩尔体积为22.4 L•mol-12 | |
| B. | 1 mol H2的质量是2 g,它所占的体积是22.4 L | |
| C. | 在标准状况下,1 mol任何气体所占的体积都为22.4 L•mol-1 | |
| D. | 在标准状况下,1 mol任何气体所占的体积都约为22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com