
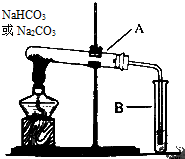
 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.分析 (2)检验二氧化碳的常用试剂为澄清石灰水,二氧化碳与氢氧化钠溶液的反应没有明显现象;
(3)碳酸氢钠分解生成的二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀;
(4)根据反应关系式计算出生成的二氧化碳气体在标况下的体积.
解答 解:(2)由于氢氧化钠溶液与二氧化碳的反应没有明显现象,所以无法检验是否有二氧化碳生成,检验二氧化碳气体的常用试剂为澄清石灰水,将二氧化碳气体通入澄清石灰水,澄清石灰水会变浑浊,
故答案为:澄清石灰水;
(3)碳酸钠加热不分解,而碳酸氢钠加热分解生成二氧化碳气体,二氧化碳通入澄清石灰水后,溶液变浑浊,生成了白色沉淀碳酸钙,说明碳酸钠稳定性>碳酸氢钠,
故答案为:>;
(4)碳酸氢钠分解的关系式为:2NaHCO3~CO2,8.4gNaHCO3的物质的量为$\frac{8.4g}{84g/mol}$=0.1mol,完全分解可以生成0.05mol二氧化碳,标况下0.05mol二氧化碳的体积为:22.4L/mol×0.05mol=1.12L,
故答案为:1.12.
点评 本题考查物质的性质实验设计,为高频考点,把握握碳酸钠、碳酸氢钠的热稳定性、反应方程式的计算等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:解答题
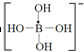 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
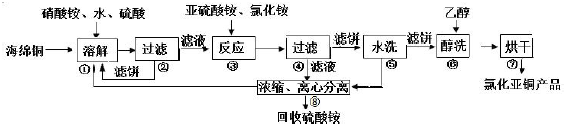
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
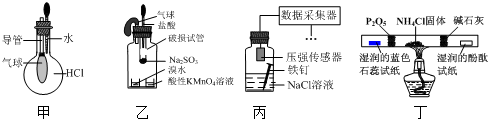
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com