


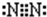 .
. 分析 (1)氢气中两个氢原子通过共用1对电子达到稳定结构;
(2)水为共价化合物,两个氢原子分别于同一个氧原子共用1对电子,氧原子最外层8个电子,分子中存在两个氧氢键;
(3)二氧化碳中碳原子分别于两个氧原子共用2对电子达到稳定结构,存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
(4)氮气分子中两个N原子形成三对共用电子对.
解答 (1)氢气中两个氢原子通过共用1对电子达到稳定结构,氢气的电子式为:H:H;
故答案为:H:H;
(2)水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,
,
故答案为: ;
;
(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
故答案为: ;
;
(4)氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为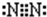 ;
;
故答案为: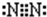 .
.
点评 本题考查了电子式的书写,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物分子中,一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 由不同元素组成的多原子分子里,一定只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ①④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2HCl═2NaCl+H2↑ | |
| B. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| C. | CuO+H2SO4═CuSO4+H2O | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃烧法除去CO2中的CO | |
| B. | 粗盐提纯操作的顺序是:溶解、过滤、洗涤、蒸发 | |
| C. | 除去铜粉中的氧化铜,可通入H2,加热 | |
| D. | 除去CaCl2中少量的CaCO3可溶于水后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
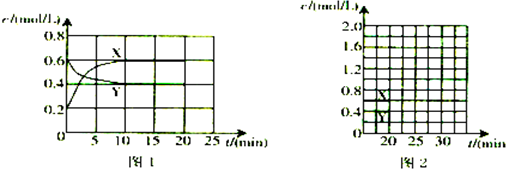
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定等于0.1mol/L | B. | 一定大于0.1mol/L | ||
| C. | 一定小于0.1mol/L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com