
【题目】下列说法正确的是
A.硫酸铁和高铁酸钾的净水原理相同
B.镧镍合金能大量吸收氢气形成金属氢化物,可作储氢材料
C.氢氧化钙是一种弱电解质
D.硅酸胶体中逐渐加入氢氧化钠溶液中,先有沉淀生成再看到沉淀溶解
科目:高中化学 来源: 题型:
【题目】下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解 | 苯与氢气(催化剂、加热) |
C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届厦门一模】磷化氢( PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为 。
(2)利用反应PH3+3HgCl2= P(HgCl)3 +3HCl,可准确测定微量的PH3。
①HgCl2溶液几乎不导电,说明HgCl2属于________________(填“共价”或“离子”)化合物。
②通过测定溶液____________变化,可测定一定体积空气中PH3的浓度。
(3)PH3的一种工业制法涉及的物质转化关系如下图所示: 
①亚磷酸属于________________元酸。
②当反应I生成的n(NaH2PO2):n(Na2HPO3) =3:1时,参加反应的n(P4):n(NaOH)= 。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为________________。
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是____________。
(5)从(4)中的吸收残留物中回收磷酸氢钙(CaHPO4)的方法如下:
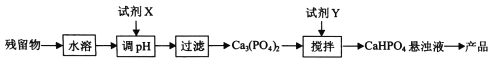
①试剂x为 (填化学式)。
②已知25℃时,H3PO4的Kal=7.5×10-3、Ka2=6.3×10-8、Ka3 =4.4×10-13。加入Y时,应控制悬浊液pH 7(填“>”、“=”或“<”),通过计算说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体的说法正确的是( )
A.乙烷的二氯代物和甲烷的二氯代物数目相同
B.丙烷的一氯代物有3种
C.苯的四氯代物有3种
D.C5H12的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届天津河东区二模】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):_____________、____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(4)一定条件下,在水溶液中1 mol E-、EOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。

(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)按要求完成下列反应的化学方程式
①1,3-丁二烯与溴单质能发生的两种加成反应 ,
②苯与浓硝酸、浓硫酸的混合物在60℃时的反应
③工业上,乙苯的制取反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为证明溴与苯发生的是取代反应而非加成反应设计了如下所示的实验装置图,其中A为一支试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再放入少量铁屑。
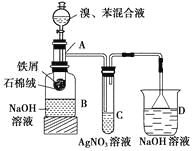
试回答下列问题:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应,写出A中所发生反应的化学方程式:_________________________(有机物要写结构简式)。
(2)反应一段时间后,在C试管内看到有浅黄色沉淀生成,此时该同学得出苯与溴的反应是取代反应而不是加成反应的结论,该结论是否正确?________(填“正确”或“不正确”),理由是__________________。
若不正确,应如何对装置进行改进?__________________________________________________。
(若回答“正确”,此问不必回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 反应需在300℃进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。结合表中列出的九种气体,试参与回答下列各题:
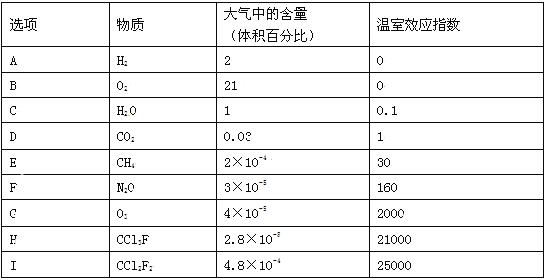
(1)下列由极性键形成的极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法不正确的是 。
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3.CHClFCF3.C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的是 。
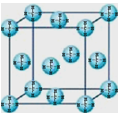
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)中钴离子在基态时核外电子排布式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com