
分析 (1)有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,其它反应都是放热反应;
(2)物质含有的能量越高,物质的稳定性越差,根据A与B的转化过程中能量变化比较二者的稳定性;
(3)固体硫变为硫蒸气需吸收热量,所以等量的S燃烧时,硫蒸气放出热量更多;
(4)破坏2 mol H2和1 mol O2需要吸收的热量为2×Q1kJ+Q2kJ=(2Q1+Q2) kJ,生成2 mol H2O释放的热量为4×Q3kJ=4Q3 kJ,由于反应放热,据此进行判断.
解答 解:(1)形成化学键、燃料的燃烧、葡萄糖在体内的氧化分解、酸碱中和反应和炸药的爆炸过程都属于放热反应,而化合反应不一定为放热反应,如二氧化碳与C的反应属于吸热反应,所以不一定释放能量的为C,
故答案为:C;
(2)A和B是同种元素的两种单质,A转化为B时需吸收能量,说明B的能量高于A,所以稳定性A的强于B,
故答案为:A;
(3)固体硫变为硫蒸气需吸收热量,所以等量的S燃烧时,硫蒸气放出热量更多,故选:B;
(4)破坏2 mol H2和1 mol O2需要吸收的热量为2×Q1kJ+Q2kJ=(2Q1+Q2) kJ,生成2 mol H2O释放的热量为4×Q3kJ=4Q3 kJ,由于反应放热,则有放出的热量大于吸收的热量,即2Q1+Q2<4Q3,故答案为:C.
点评 本题考查了化学反应与能量变化等,题目难度中等,注意掌握吸热反应与放热反应的概念,(2)为易错点,注意物质稳定性与物质能量大小之间关系.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:多选题
| A. | K+、CO32-、Cl-、NO3- | B. | K+、Fe2+、I-、SO42- | ||
| C. | Ba2+、Na+、Cl-、NO3- | D. | Na+、Ca2+、Al3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
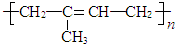 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
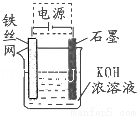 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
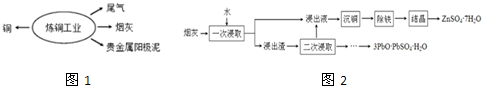
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com