
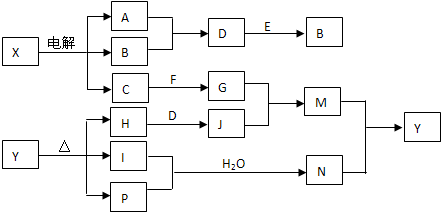
| ||
| ||


科目:高中化学 来源: 题型:
| A、T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-6NA |
| B、12.0gNaHSO4固体中含有的阳离子数目为0.1NA |
| C、50g98%的浓硫酸中,所含的氧原子数目为2NA |
| D、1molNa2O2与足量CO2充分反应转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | H2(g)+O2(g)═H2O(g)△H═-242kJ/mol; |
| ② | 2H2(g)+O2(g)═2H2O(l)△H═-572kJ/mol; |
| ③ | C(s)+O2(g)═CO(g)△H═-110.5kJ/moL; |
| ④ | C(s)+O2(g)═CO2(g)△H═-393.5kJ/moL; |
| ⑤ | CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL |
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
查看答案和解析>>
科目:高中化学 来源: 题型:
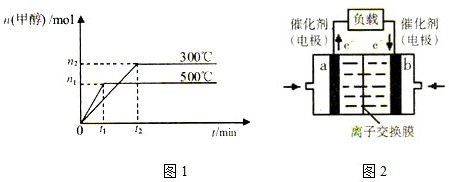
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
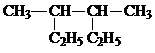 名称:
名称: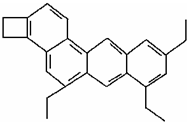
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com