
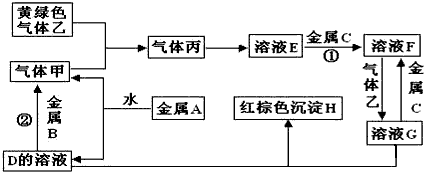
| ||
| ||


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
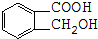 .试回答:
.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
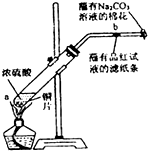 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
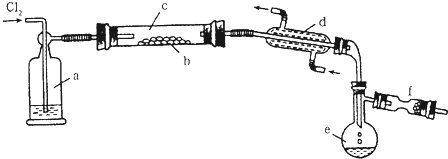
查看答案和解析>>
科目:高中化学 来源: 题型:
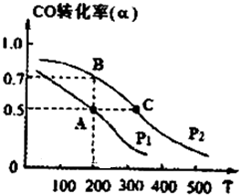 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:| 1 |
| 2 |
| C(H2) |
| C(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HNO3在反应中既表现氧化性也表现出酸性 |
| B、每生成22.4L NO(标准状况)有3mol电子转移 |
| C、HNO3作氧化剂,铜作还原剂,3mol Cu还原8mol的HNO3 |
| D、HNO3作氧化剂,铜作还原剂,3mol Cu还原2mol的HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com