
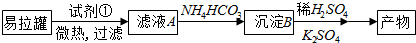
分析 易拉罐的主要成分为Al,含有少量的Fe、Mg杂质,可选择浓NaOH溶解,得到偏铝酸钠溶液,并通过过滤除去Fe、Mg等杂质,滤液中加入NH4HCO3溶液后,促进AlO2-水解生成Al(OH)3沉淀,过滤后将沉淀溶解在稀硫酸中,得到硫酸铝溶液,添加K2SO4溶液后蒸发浓缩并冷却结晶得到晶体明矾;
(1)铝是两性金属能与强酸、强碱反应,而Mg、Fe只能溶解于酸,据此选择试剂;
(2)用NaOH溶液溶解Al生成偏铝酸钠及氢气,据此写出反应化学方程式;
(3)滤液中加入NH4HCO3溶液后,促进AlO2-水解生成Al(OH)3沉淀;Al3+水解使明矾溶液显酸性;
(4)Al(OH)3沉淀溶解在NaOH溶液里发生的反应为Al(OH)3+OH-?AlO2-+2H2O,结合水的离子积和氢氧化铝的电离平衡常数计算此反应的平衡常数.
解答 解:(1)根据铝能溶解在强酸和强碱性溶液,而铁和镁只能溶解在强酸性溶液中的性质差异,可选择NaOH溶液溶解易拉罐,可除去含有的铁、镁等杂质,故答案为:d;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)滤液中加入NH4HCO3溶液后,电离出的NH4+和HCO3-均能促进AlO2-水解,反应式为NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O,生成Al(OH)3沉淀;因Al3++3H2O?Al(OH)3+3H+,则明矾水溶液显酸性,故答案为:Al(OH)3;Al3+水解,使溶液中H+浓度增大;
(4)Al(OH)3?AlO2-+H++H2O①H2O?H++OH-②,①-②可得Al(OH)3+OH-?AlO2-+2H2O,则Al(OH)3溶于NaOH溶液反应的平衡常数=K÷Kw=$\frac{2.0×1{0}^{-13}}{1.0×1{0}^{-14}}$=20,故答案为:20.
点评 本题以铝制备明矾为载体,考查物质的制备与设计,涉及反应原理的探究及溶解平衡与水电离平衡常数的应用、盐类水解等,属基础考查,中等难度,易错点为(4)平衡常数的计算.


科目:高中化学 来源: 题型:选择题
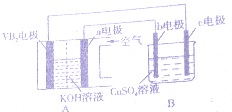 碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )| A. | VB2电极发生的电极反应为:2VB2+11H20-22e-═V205+2B203+22H+ | |
| B. | 若B装置内液体的体积一直为200mL,则原CuS04溶液浓度为0.05 mol/L | |
| C. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| D. | 外电路中电子由c电极流向VB2电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据悉中国在建的第二艘航母中使用了素有“现代工业的骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料 | |
| B. | 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜 | |
| C. | 获得屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| D. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为2.408×1023个 | |
| C. | 可生成H2的体积为0.224L(标准情况) | |
| D. | 生成H2的量理论上等于0.04mol Na与水反应产生H2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
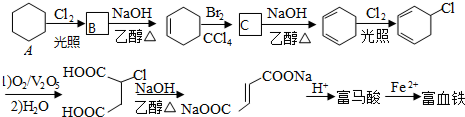
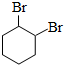 .
. .
.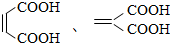 (写出结构简式).
(写出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
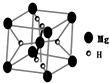 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中离子半径最大的为M | |
| B. | Y、Z、M的氢化物中,M的氢化物沸点最高 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物,不能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com