
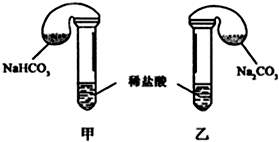
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
分析 (1)甲装置发生反应HCO3-+H+═H2O+CO2↑,乙装置发生反应CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,据此判断反应速率大小;
(2)根据n=$\frac{m}{M}$分别计算出碳酸氢钠、碳酸钠的物质的量,再根据n=cV计算出盐酸中含有HCl的物质的量,然后根据反应方程式判断过量情况,从而可知甲和乙的反应现象及原因.
解答 解:(1)甲装置发生反应为:HCO3-+H+═H2O+CO2↑,乙装置发生反应为:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,甲装置内反应速率较快,单位时间产生的CO2多,故甲装置中的气球体积先变大,
故答案为:甲;HCO3-+H+═H2O+CO2↑;
(2)第②组中碳酸氢钠的物质的量为:n=$\frac{m}{M}$=$\frac{42g}{84g/mol}$=0.5mol,碳酸钠的物质的量为:n=$\frac{m}{M}$=$\frac{53g}{106g/mol}$=0.5mol,则n(NaHCO3)=n(Na2CO3),300mL3 mol/L盐酸中含有HCl的物质的量为:3mol/L×0.3L=0.9mol
HCO3-+H+═H2O+CO2↑,0.5mol碳酸氢钠完全反应消耗0.5molHCl,而0.5mol碳酸钠CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,完全反应消耗1molHCl,显然甲中盐酸过量,乙中盐酸不足量,则甲乙装置中放出二氧化碳的体积大小为:V(CO2)甲>V(CO2)乙,所以甲中气球比乙中气球的体积大,
故答案为:大于;甲中盐酸过量,乙中盐酸不足量、n(NaHCO3)=n(Na2CO3)、V(CO2)甲>V(CO2)乙.
点评 本题考查了碳酸钠、碳酸氢钠的性质,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握碳酸钠、碳酸氢钠的化学性质,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
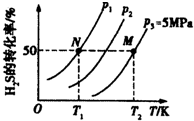 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
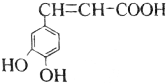
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3molCO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
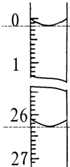 某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:
某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=26.20 |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
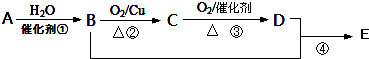
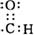 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- | |
| B. | 将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含钾 | |
| C. | 待检液逐滴加入NaOH溶液,有白色胶状沉淀产生,后来沉淀逐渐消失,则原溶液中可能含有Al3+ | |
| D. | 待检液中先加入KSCN溶液,无明显现象,再加入氯水,溶液显血红色,则待检液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入到 CaCl2溶液中 | |
| B. | NH3通入 AlCl3溶液中 | |
| C. | 用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
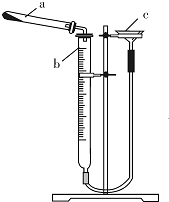 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com