
| A. | 1个 | B. | 2 | C. | 3 | D. | 4 |
分析 ①固体在反应过程中没有浓度变化;
②化学反应速率指的是平均化学反应速率;
③升高温度改变活化分子百分数,反应速率一定改变;
④针对有气体参加的反应,改变压强不一定能使平衡发生移动,如反应前后气体物质的量之和不变的反应;
⑤在固定体积的密闭容器中进行反应:2HI(g)?H2(g)+I2(g),当反应体系的颜色不再变化,说明碘的浓度不变;
⑥升高温度,化学平衡常数增大,说明平衡正向移动,升高温度平衡向吸热方向移动;
⑦当△H-T△S<0,反应自发进行.
解答 解:①固体在反应过程中没有浓度变化,A是固体,在反应前后固体成分不变,所以不能用A表示反应速率,故错误;
②化学反应速率指的是平均化学反应速率而不是瞬时速率,故错误;
③升高温度使部分非活化分子转化为活化分子,所以活化分子百分数增大,反应速率一定增大,故错误;
④针对有气体参加的反应,改变压强不一定能使平衡发生移动,如反应前后气体物质的量之和不变的反应,故正确;
⑤在固定体积的密闭容器中进行反应:2HI(g)?H2(g)+I2(g),当反应体系的颜色不再变化,说明碘的浓度不变,正逆反应速率相等,则该反应达到平衡状态,故正确;
⑥升高温度,化学平衡常数增大,说明平衡正向移动,升高温度平衡向吸热方向移动,说明正反应是吸热反应,故错误;
⑦当△H-T△S<0,反应自发进行,△H>0,△S<0,△H-T△S>0,所有温度下反应不能自发进行,故错误;
故选B.
点评 本题考查较综合,涉及平衡状态判断、反应热的判断、反应自发性判断、化学反应速率影响因素等知识点,明确化学反应原理及其影响因素是解本题关键,知道反应自发性及化学平衡状态判断方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
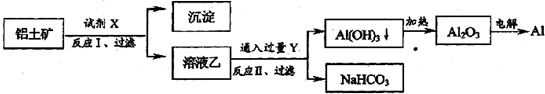
| A. | 试剂X为稀硫酸 | |
| B. | 反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| C. | 结合质子( H+)的能力由强到弱的顺序是:OH->HCO3->AlO2- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,12C碳-12原子所含有的碳原子数目的物质的量为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑦ | C. | ③④⑥ | D. | 全有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶液和Na2SO4溶液 | B. | 金属钠和MgCl2溶液 | ||
| C. | 金属铝和NaOH溶液 | D. | FeCl3溶液和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| B. | 硅是构成矿石和岩石的主要元素,硅在地壳中的含量在所有元素中居第二位 | |
| C. | 单晶硅常用于制造光导纤维 | |
| D. | 可用石英坩埚加热NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com