


科目:高中化学 来源: 题型:阅读理解
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2来中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
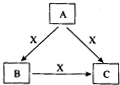 A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州二中高一下学期期中考试化学理科试卷(带解析) 题型:实验题
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1, 催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol?L-1)的用量均为2mL。
(1)配平化学方程式:
______KMnO4 +____H2C2O4 +_____H2SO4 → ____K2SO4 +_____MnSO4 +_____CO2 +______H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/ g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和______探究催化剂对该反应速率的影响 |
| ② | | | | |
| ③ | | | | |
| ④ | | 0 | |
| KMnO4酸性溶液 的浓度 / mol?L-1 | 溶液褪色所需时间 t / min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com