
| A�� | �����Һ����ˮ�������c��OH-���T10-8 mol•L-1 | |
| B�� | c��Na+���Tc��X-��+c��HX��=0.1mol•L-1 | |
| C�� | c��Na+��-c��X-���T9.9��10-7mol•L-1 | |
| D�� | c��OH-��-c��HX���Tc��H+��=1��10-8mol•L-1 |
���� 0.2mol•L-1HX��Һ��0.2mol•L-1NaOH��Һ�������ϣ�����ǡ�÷�Ӧ����NaX����û����ҺpH=8��Ϊ���ԣ�˵��NaX��ǿ�������Σ�
A��NaX��ǿ�������Σ����������ˮ��ٽ�ˮ���룬�����Һ����ˮ�������c��OH-��=$\frac{{K}_{W}}{1{0}^{-pH}}$��
B���������Һ�������һ����Ũ�Ƚ�Ϊԭ��һ�룻
C���κε������Һ�ж����ڵ���غ㣬���ݵ���غ���㣻
D���κε������Һ�ж����ڵ���غ�������غ㣬���ݵ���غ�������غ���㣮
��� �⣺0.2mol•L-1HX��Һ��0.2mol•L-1NaOH��Һ�������ϣ�����ǡ�÷�Ӧ����NaX����û����ҺpH=8��Ϊ���ԣ�˵��NaX��ǿ�������Σ�
A��NaX��ǿ�������Σ����������ˮ��ٽ�ˮ���룬�����Һ����ˮ�������c��OH-��=$\frac{{K}_{W}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6 mol/L����A����
B���������Һ�������һ����Ũ�Ƚ�Ϊԭ��һ�룬��������غ��c��Na+���Tc��X-��+c��HX��=0.1mol•L-1����B��ȷ��
C���κε������Һ�ж����ڵ���غ㣬���ݵ���غ��c��Na+��-c��X-���Tc��OH-��-c��H+���T10-6 mol/L-10-8mol/L=9.9��10-7mol•L-1����C��ȷ��
D���κε������Һ�ж����ڵ���غ�������غ㣬���ݵ���غ�c��Na+��+c��H+���T
c��X-��+c��OH-�������������غ��c��Na+���Tc��X-��+c��HX�������Ե�c��OH-��-c��HX���Tc��H+��=1��10-8mol•L-1����D��ȷ��
��ѡA��
���� ���⿼������Ũ�ȴ�С�Ƚϣ�Ϊ��Ƶ���㣬��ȷ��Һ�����ʼ��������ǽⱾ��ؼ���ע���غ�˼���������ã��״�ѡ����AB��ע�⺬�������ӵ�����ˮ����������ӻ�����������Ũ�ȼ��㷽����ע��B�ж����ʱ�������һ����Ϊ�״��㣮


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
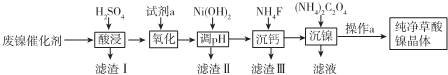
| �������� | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| ��ʼ������pH | 1.1 | 5.8 | 3.0 | 6.8 |
| ��ȫ������pH | 3.2 | 8.8 | 5.0 | 9.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��Al��OH��3 | B�� | H2��NaAlO2 | C�� | H2��NaAlO2��NaCl | D�� | H2��Al��OH��3��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
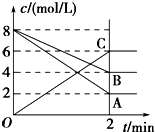 ����ͼ��գ�
����ͼ��գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5��2 | B�� | 3��1 | C�� | 15��2 | D�� | 1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������������칹�����ٴ���ʹ�ù㷺��ҩ���ͼ��ʾ��Ϊ������ϳ�·���е�һ������Ӧ�Լ��ͷ�Ӧ������δ�����
�������������칹�����ٴ���ʹ�ù㷺��ҩ���ͼ��ʾ��Ϊ������ϳ�·���е�һ������Ӧ�Լ��ͷ�Ӧ������δ�����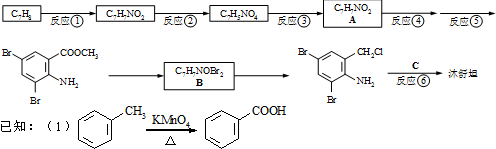
 +2
+2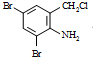 +K2CO3��2
+K2CO3��2 +2KCl+CO2��+H2O
+2KCl+CO2��+H2O B
B
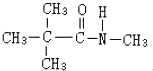 ��
��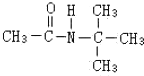
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com