
| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
分析 A、燃烧热为正值;
B、测定中和热的方法是利用量热计测定开始和反应终止时的温度计算得到;
C、燃烧热是C燃烧生成CO2时放出的热量;
D、浓硫酸溶解放热.
解答 解:A、1mol氢气燃烧生成液态水放出的热量是氢气的燃烧热,则H2的燃烧热为:285.8kJ•mol-1,故A错误;
B、中和热测定需要酸和碱溶液温度相同,利用测定开始和反应终了温度,依据Q=-C(T2-T1)计算反应的反应热,需要测定3个温度,故B正确;
C、C的燃烧热是C完全燃烧生成CO2时放出的热量,故C错误;
D、浓硫酸溶解时放热,0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ,故D错误.
故选:B.
点评 本题考查了燃烧热、中和热概念的分析应用,中和热的测定方法,题目难度不大,侧重于基础知识的考查.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 任何条件下,等物质的量的Cl2和HCl所含的分子数必相等 | |
| C. | 1LHCl气体一定比1L Cl2气体的质量小 | |
| D. | 22.4LHCl气体的物质的量恰好是11.2LHCl气体的物质的量的二倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
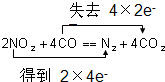
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 高炉炼铁中炉渣的主要成分是硅酸钙 | |
| C. | 除去FeCl2溶液中的FeCl3杂质,可向溶液中加入足量铜粉,然后过滤 | |
| D. | Fe3+与KSCN溶液反应产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:C=1:2 | D:E=1:3 | B:E=1:4 |
 ,丁的结构式
,丁的结构式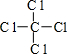
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.2 mol/(L•min) | B. | v(N2)=0.2 mol/(L•s) | ||
| C. | v(N2)=0.02 mol/(L•s) | D. | v(H2)=0.04 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
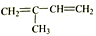 ⑤
⑤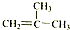 ⑥CH3CH(C2H5)CH2CH(C2H5)CH3 ⑦C5H10 ⑧ClCH=CHCl ⑨C5H4
⑥CH3CH(C2H5)CH2CH(C2H5)CH3 ⑦C5H10 ⑧ClCH=CHCl ⑨C5H4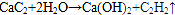 .
.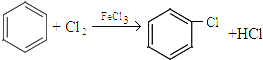 .
. .
.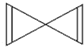 D.
D.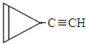 e.
e.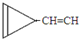 …
… 或
或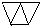 (只需答出一例的结构简式).
(只需答出一例的结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com