
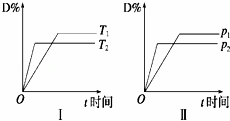
对于可逆反应mA(g)+nB(s)⇌pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )
|
| A. | 化学方程式中化学计量数:m>p+q |
|
| B. | 降温可使化学平衡向正反应方向移动 |
|
| C. | 使用合适的催化剂可使D%有所增加 |
|
| D. | B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
考点:
产物的百分含量随浓度、时间的变化曲线;化学平衡建立的过程.
专题:
化学平衡专题.
分析:
A.由图Ⅱ可知,P2>P1,增大压强,D的含量减小,平衡逆向移动;
B.由图Ⅰ可知,T2>T1,升高温度,D的含量减小,平衡逆向移动;
C.催化剂对化学平衡不产生影响;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,对化学平衡不产生影响.
解答:
解:A.由图Ⅱ可知,P2>P1,增大压强,D的含量减小,平衡逆向移动,故m<p+q,故A错误;
B.由图Ⅰ可知,T2>T1,升高温度,D的含量减小,平衡逆向移动,故降低温度,平衡正向移动,故B正确;
C.催化剂对化学平衡不产生影响,故C错误;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,对化学平衡不产生影响,故D错误,
故选B.
点评:
本题考查外界条件对化学反应速率和化学平衡的影响,难度中等.要注意催化剂和颗粒大小对化学平衡不产生影响.


科目:高中化学 来源: 题型:
在一定条件下用NH3捕获CO2可以生成重要的有机化工产品﹣﹣三聚氰酸,反应的化学方程式如下:NH3+CO2→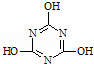 +H2O下列有关三聚氰酸的说法正确的是()
+H2O下列有关三聚氰酸的说法正确的是()
A. 分子式为C3H6N3O3
B. 分子中既含极性键,又含非极性键
C. 属于共价化合物
D. 生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 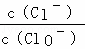 的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是()
的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是()
A. 若某温度下,反应后 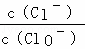 =11,则溶液中
=11,则溶液中 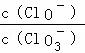 =
=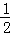
B. 参加反应的被还原的氯气为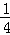 amol
amol
C. 改变温度,反应中转移电子的物质的量ne的范围: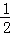 amol≤ne≤
amol≤ne≤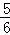 amol
amol
D. 改变温度,产物中KClO3的最大理论产量为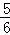 amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
多硫化钙[CaSx( x≤5)]、硫代硫酸钙组成的混合物称为石硫合剂,它是一种很好的植物杀虫剂,是由硫磺跟石灰、水等反应所得.不同比例的硫磺跟石灰在水溶液中反应,可生成不同的多硫化钙与硫代硫酸钙.
3Ca(OH)2+8S 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
完成下列计算:
(1)硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,则该Na2Sx中x=4.
(2)取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/cm3)通入足量CO2使其快速分解.原理如下:Sx2﹣+2H2O+2CO2→(x﹣1)S↓+H2S↑+2HCO3﹣;S2O32﹣+H2O+CO2→HSO3﹣+HCO3﹣+S↓
完全反应后共收集到气体1.12升(标准状况)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 .(答案用小数表示,保留2位有效数字)
(3)如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 .
(4)现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙.请推算这二种多硫化钙可能的物质的量之比 (写出推理过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
mA(s)+nB(g)⇌qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是( )
|
| A. | n<q | B. | n>q |
|
| C. | 正反应为放热反应 | D. | X点比Y点反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2、CH3COOH是生活中常见的物质,在化学研究中应用广泛.
(1)某小组拟在Fe3+的催化下,探究H2O2分解速率影响的某一因素.限选试剂与仪器:30% H2O2、0.1mol∙L﹣1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
将表中所给的混合溶液分别加入到2个同容积的锥形瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol∙L﹣1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
表中Vx= mL,实验目的是 .
(2)醋酸和盐酸是化学实验中常见的二种一元酸,某小组设计下列实验证明它们的电离程度.
实验一:室温下,测出0.1mol•L﹣1醋酸和盐酸pH值分别为3、1.提示:pH=﹣lgc(H+)
结论一:醋酸在水溶液中电离 (填“完全”、“不完全”).该温度下醋酸的电离度为 ;写出醋酸的电离方程式 .
实验二:现取等体积、浓度均为1mol•L﹣1醋酸和盐酸分别加入经砂纸打磨过的表面积相同的镁条.观察放出氢气速率的快慢.
结论二:其它条件相同时,同浓度同体积的一元酸与金属反应时,反应 (填“快”或“慢”)的为弱电解质.
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积相同的两个密闭的容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
-A.-两种气体的压强相等
-B.-O2比O3的质量小
-C.-两种气体所含的质子数目相等
-D.-两种气体的分子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
检验某未知溶液中是否含有SO42﹣,下列操作最合理的是( )
|
| A. | 加入稀硝酸酸化的Ba(NO3)2溶液 |
|
| B. | 加入盐酸酸化的BaCl2溶液 |
|
| C. | 先加稀硝酸酸化,再加Ba(NO3)2溶液 |
|
| D. | 先加盐酸酸化,再加BaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com