
| A、石墨上发生氧化反应 |
| B、电解质溶液中的OH-移向正极 |
| C、电子由石墨通过外电路流向锌片 |
| D、该电池使用中无需补充氢氧化钾溶液 |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| A、等于0.5 | B、大于0.5 |
| C、小于0.5 | D、大于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②④⑤ |
| C、②④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥⑧⑩ |
| B、①④⑤⑥⑧⑨ |
| C、①②④⑥⑧⑨ |
| D、②③④⑤⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?CO32-+H3O+ |
| B、HCO3-+H2O?H2CO3+OH- |
| C、HCO3-+OH-?CO32-+H2O |
| D、CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成SO3为2mol |
| B、SO2和SO3物质的量之和一定为3mol |
| C、放出197kJ 的热量 |
| D、SO2 的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
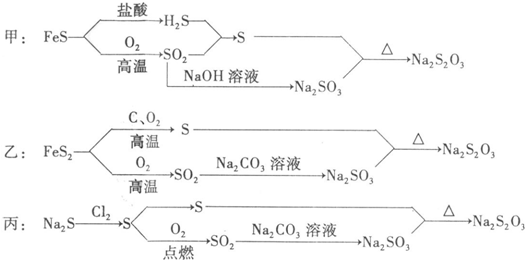
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
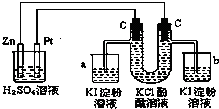 按照图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com