
æ×ČøŹÆÖ÷ŅŖŗ¬Cu2(OH)2CO3£¬»¹ŗ¬ÉŁĮæĢśµÄ»ÆŗĻĪļŗĶ¹čµÄ»ÆŗĻĪļ”£ŅŌæ×ČøŹÆĪŖŌĮĻæÉÖʱøCuCl2”¤3H2O¼°“æ¼ī£¬Į÷³ĢČēĶ¼ĖłŹ¾”£
ŅŃÖŖ£ŗČÜŅŗAÖ»ŗ¬Cu2£«”¢Fe2£«”¢Fe3£«ČżÖÖ½šŹōĄė×Ó£¬ĒŅČżÖÖĄė×Ó³ĮµķŹ±µÄpHČē±ķĖłŹ¾”£»Ų“šĻĀĮŠĪŹĢā£ŗ
| ½šŹōĄė×Ó | Fe3£« | Fe2£« | Cu2£« | |
| pH | ĒāŃõ»ÆĪļ æŖŹ¼³Įµķ | 1.9 | 7.0 | 4.7 |
| ĒāŃõ»ÆĪļ ĶźČ«³Įµķ | 3.2 | 9.0 | 6.7 | |
 Cu(OH)2£«2H£«µÄĘ½ŗā³£ŹżĪŖ________”£
Cu(OH)2£«2H£«µÄĘ½ŗā³£ŹżĪŖ________”£ 
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
Ļņ20.00mLĻ”H2SO4ÖŠÖšµĪ¼ÓČė0.10mol/LµÄ°±Ė®£¬²āµĆČÜŅŗµÄpHĖę¼ÓČė°±Ė®µÄĢå»ż±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ(””””) 
| A£®x=20 |
| B£®Ļ”H2SO4µÄÅضČĪŖ0.10mol/L |
| C£®bµćÓŠ£ŗ2c(NH4+) = c(SO42-)> c(H+) = c(OH-) |
| D£®aµćÓŠ£ŗc(NH4+) < 2c(SO42-) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚĻ”°±Ė®ÖŠ“ęŌŚĻĀŹöµēĄėĘ½ŗāNH3+H2O NH3 ”¤H2O
NH3 ”¤H2O NH4++OH££¬·Ö±š¼ÓČėÉŁĮæĻĀĮŠĪļÖŹ£¬ČÜŅŗÖŠc(OH£)ČēŗĪ±ä»Æ£æ(Ģī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±)£»Ę½ŗāŅĘ¶Æ·½ĻņČēŗĪ£æ(Ģī”°ÕżĻņ”±”°ÄęĻņ”±»ņ”°²»ŅĘ¶Æ”±)
NH4++OH££¬·Ö±š¼ÓČėÉŁĮæĻĀĮŠĪļÖŹ£¬ČÜŅŗÖŠc(OH£)ČēŗĪ±ä»Æ£æ(Ģī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±)£»Ę½ŗāŅĘ¶Æ·½ĻņČēŗĪ£æ(Ģī”°ÕżĻņ”±”°ÄęĻņ”±»ņ”°²»ŅĘ¶Æ”±)
| ¼ÓČėµÄĪļÖŹ | ÉŁĮæ(NH4)2SO4¹ĢĢå | ÉŁĮæHNO3ČÜŅŗ | ÉŁĮæKOHČÜŅŗ |
| c(OH-)µÄ±ä»Æ | | | |
| Ę½ŗāŅĘ¶Æ·½Ļņ | | | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
½ńÓŠÅØ¶Č¾łĪŖ0£®1mol/LµÄ“×Ėį”¢ŃĪĖįŗĶĮņĖįČżÖÖĻ”ČÜŅŗ£¬°“ĻĀĮŠĢāŹ¾»Ų“šĪŹĢā£Ø»Ų“šŹ±ÓĆ”°£¾”±”¢”°£¼”±»ņ”°=”±Į¬½Óa”¢b”¢c£©£ŗ
£Ø1£©ÉčČżÖÖČÜŅŗµÄpH·Ö±šĪŖa”¢b”¢c£¬Ōņ“󊔹ŲĻµĪŖ ”£
£Ø2£©ČōČ”µČÖŹĮæµÄŠæ·Ö±šøśÕāČżÖÖČÜŅŗ·“Ó¦£¬Ź¹ŠæĒ”ŗĆĶźČ«·“Ó¦Ź±£¬ĖłĻūŗÄČżÖÖĖįµÄĢå»ż·Ö±šĪŖa”¢b”¢c£¬ŌņĘä“󊔹ŲĻµĪŖ ”£
£Ø3£©Č”ÉĻŹöČżÖÖČÜŅŗø÷10mL£¬·Ö±šøś0£®1mol/LNaOHČÜŅŗ10mL»ģŗĻ£¬µ±·“Ó¦½įŹųŗó£¬ČżÖÖ»ģŗĻŅŗµÄpH·Ö±šĪŖa”¢b”¢c £¬ŌņĘä“󊔹ŲĻµĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
pCĄąĖĘpH,ŹĒÖø¼«Ļ”ČÜŅŗÖŠ,ČÜÖŹĪļÖŹµÄĮæÅØ¶ČµÄ³£ÓƶŌŹżøŗÖµ”£ČēijČÜŅŗČÜÖŹµÄÅضČĪŖ1”Į10-3mol”¤L-1,ŌņøĆČÜŅŗÖŠČÜÖŹµÄpC=-lg(1”Į10-3)=3”£ĻĀĶ¼ĪŖ,H2CO3ŌŚ¼ÓČėĒæĖį»ņĒæ¼īČÜŅŗŗó,Ę½ŗāŹ±ČÜŅŗÖŠČżÖֳɷֵÄpC”ŖpHĶ¼”£Ēė»Ų“šĻĀĮŠĪŹĢā: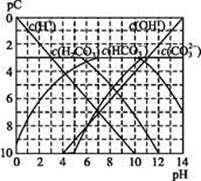
(1)ŌŚČĖĢåŃŖŅŗÖŠ,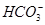 ÄÜĘšµ½Ź¹ČĖĢåŃŖŅŗpH±£³ÖŌŚ7.35~7.45µÄ×÷ÓĆ”£¢ŁĒėÓƵē½āÖŹČÜŅŗÖŠµÄĘ½ŗā½āŹĶ:””””””””””””””””””””””””””””””(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
ÄÜĘšµ½Ź¹ČĖĢåŃŖŅŗpH±£³ÖŌŚ7.35~7.45µÄ×÷ÓĆ”£¢ŁĒėÓƵē½āÖŹČÜŅŗÖŠµÄĘ½ŗā½āŹĶ:””””””””””””””””””””””””””””””(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
¢ŚÕż³£ČĖĢåŃŖŅŗÖŠ,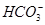 µÄĖ®½ā³Ģ¶Č””””””””µēĄė³Ģ¶Č(Ģī”°<”±”°>”±»ņ”°=”±)”£
µÄĖ®½ā³Ģ¶Č””””””””µēĄė³Ģ¶Č(Ģī”°<”±”°>”±»ņ”°=”±)”£
¢ŪpH=7.00µÄŃŖŅŗÖŠ,c(H2CO3)””””””””c(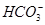 )(Ģī”°<”±”°>”±»ņ”°=”±)”£
)(Ģī”°<”±”°>”±»ņ”°=”±)”£
(2)H2CO3Ņ»¼¶µēĄėĘ½ŗā³£ŹżµÄŹżÖµ ”Ö”””””””””£
”Ö”””””””””£
(3)ijĶ¬Ń§ČĻĪŖøĆČÜŅŗÖŠNa2CO3µÄĖ®½āŹĒĪ¢ČõµÄ,·¢ÉśĖ®½āµÄC ²»³¬¹żĘä×ÜĮæµÄ10%”£ĒėÄćÉč¼Ę¼ņµ„ŹµŃéÖ¤Ć÷øĆĶ¬Ń§µÄ¹ŪµćŹĒ·ńÕżČ·”£
²»³¬¹żĘä×ÜĮæµÄ10%”£ĒėÄćÉč¼Ę¼ņµ„ŹµŃéÖ¤Ć÷øĆĶ¬Ń§µÄ¹ŪµćŹĒ·ńÕżČ·”£
(4)ŅŃÖŖijĪĀ¶ČĻĀLi2CO3µÄKspĪŖ1.68”Į10-3,½«ŹŹĮæLi2CO3¹ĢĢåČÜÓŚ100 mLĖ®ÖŠÖĮøÕŗƱ„ŗĶ,±„ŗĶLi2CO3ČÜŅŗÖŠc(Li+)="0.15" mol”¤L-1.c( )="0.075" mol”¤L-1”£Čōt1Ź±æĢŌŚÉĻŹöĢåĻµÖŠ¼ÓČė100 mL 0.125 mol”¤L-1 Na2CO3ČÜŅŗ,ĮŠŹ½¼ĘĖćĖµĆ÷ŹĒ·ńÓŠ³Įµķ²śÉś”£
)="0.075" mol”¤L-1”£Čōt1Ź±æĢŌŚÉĻŹöĢåĻµÖŠ¼ÓČė100 mL 0.125 mol”¤L-1 Na2CO3ČÜŅŗ,ĮŠŹ½¼ĘĖćĖµĆ÷ŹĒ·ńÓŠ³Įµķ²śÉś”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ø“·Ö½ā·“Ó¦ŹĒ֊ѧ»Æѧ֊³£¼ūµÄŅ»ÖÖ·“Ó¦ĄąŠĶ”£
(1)ŅŃÖŖŌŚ³£ĪĀĻĀ²āµĆÅØ¶Č¾łĪŖ0.1 mol”¤L£1µÄĻĀĮŠ6ÖÖČÜŅŗµÄpH(C6H5OHĻąµ±ÓŚŅ»ŌŖČõĖį)£ŗ
| ČÜÖŹ | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
(1)ÅØ¶Č¾łĪŖ0.01 mol”¤L-1µÄ8ÖÖČÜŅŗ:¢ŁHNO3””¢ŚH2SO4””¢ŪCH3COOH””¢ÜBa(OH)2””¢ŻNaOH
¢ŽCH3COONa””¢ßKCl””¢ąNH4Cl,ÕāŠ©ČÜŅŗpHÓÉŠ”µ½“óµÄĖ³ŠņŹĒ(ĢīŠ“±ąŗÅ)”””””””””””””””””””£
(2)pH=2µÄijĖįHnA(An+ĪŖĖįøł)ÓėpH=12µÄij¼īB(OH)m»ģŗĻ,Ē”ŗĆ·“Ӧɜ³ÉÕżŃĪ,»ģŗĻŅŗpH=8”£
¢Ł·“Ӧɜ³ÉµÄÕżŃĪµÄ»ÆѧŹ½ĪŖ”””””””””””””””””£
¢ŚøĆŃĪÖŠ””””””””Ąė×ÓŅ»¶ØÄÜĖ®½ā,Ę䵌Ņ»²½Ė®½āµÄĄė×Ó·½³ĢŹ½ĪŖ”””””””””””””””””””””””””£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ä³Ń§ÉśÓĆ0.100 mol”¤L-1µÄKOH±ź×¼ČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖį,Ęä²Ł×÷æÉ·Ö½āĪŖČēĻĀ¼ø²½:
| A£®ŅĘČ”20.00 mL“ż²āŃĪĖįČÜŅŗ×¢Čė½ą¾»µÄ׶ŠĪĘæ,²¢¼ÓČė2~3µĪ·ÓĢŖ; |
| B£®ÓƱź×¼ČÜŅŗČóĻ“µĪ¶Ø¹Ü2~3“Ī; |
| C£®°ŃŹ¢ÓŠ±ź×¼ČÜŅŗµÄ¼īŹ½µĪ¶Ø¹Ü¹Ģ¶ØŗĆ,µ÷½ŚµĪ¶Ø¹Ü¼ā×ģŹ¹Ö®³äĀśČÜŅŗ; |
| D£®Č”±ź×¼KOHČÜŅŗ×¢Čė¼īŹ½µĪ¶Ø¹ÜÖĮæĢ¶Č”°0”±ŅŌÉĻ2~3 mL; |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¹¤ŅµÉĻĄūÓĆŠæ±ŗÉ°£ØÖ÷ŅŖŗ¬ZnO”¢ZnFe2O4£¬»¹ŗ¬ÓŠÉŁĮæCaO”¢FeO”¢CuO”¢NiOµČŃõ»ÆĪļ£©ÖĘČ”½šŹōŠæµÄĮ÷³ĢČēĶ¼ĖłŹ¾”£»Ų“šĻĀĮŠĪŹĢā£ŗ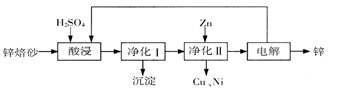
£Ø1£©Ėį½žŹ±ZnFe2O4»įÉś³ÉĮ½ÖÖŃĪ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ
£Ø2£©¾»»ÆI²Ł×÷·ÖĪŖĮ½²½£ŗµŚŅ»²½ŹĒ½«ČÜŅŗÖŠÉŁĮæµÄFe2£«Ńõ»Æ£»µŚ¶ž²½ŹĒæŲÖĘČÜŅŗpH£¬Ź¹Fe3£«×ŖĪŖFe(OH)3³Įµķ”£
¢ŁŠ“³öĖįŠŌĢõ¼žĻĀH2O2ÓėFe2£«·“Ó¦µÄĄė×Ó·½³ĢŹ½
¢Ś250CŹ±£¬pH=3µÄČÜŅŗÖŠ£¬c (Fe3£«)£½ mol/L£ØŅŃÖŖ25”ę£¬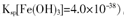 ”£
ӣ
¢Ū¾»»ÆIÉś³ÉµÄ³ĮµķÖŠ»¹ŗ¬ÓŠČÜŅŗÖŠµÄŠüø”ŌÓÖŹ£¬ČÜŅŗÖŠµÄŠüø”ŌÓÖŹ±»¹²Ķ¬³ĮµķµÄŌŅņŹĒ ”£
£Ø3£©Čōƻӊ¾»»ÆII²Ł×÷£¬Ōņ¶ŌŠæµÄÖʱø“ųĄ“µÄÓ°ĻģŹĒ ”£
£Ø4£©±¾Į÷³ĢÖŠæÉŅŌŃ»·ĄūÓƵÄĪļÖŹ³żŠæĶā»¹ÓŠ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com