
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、制取氢气 |
| B、粗盐提纯 |
| C、分离苯和水的混合物 |
| D、用氯化钠晶体配制100g 5%的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学平衡常数均无单位 |
| B、平衡常数越大则转化率越大 |
| C、对于一个化学计量数固定的反应,平衡常数的大小只与温度有关 |
| D、在平衡常数表达式中,反应物的浓度为初始浓度,生成物的浓度为平衡浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D、可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y与R形成的化合物对应的水化物一定是强酸 |
| B、如W与Y形成化合物的化学式为WY2,则WY2能与碱反应,但不能与任何酸反应 |
| C、原子半径按X、Y、W、R、Z的顺序依次增大 |
| D、R的气态氢化物一定比W的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
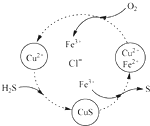 完成下列各小题的计算
完成下列各小题的计算查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L溶液中含有K+数目是0.1NA |
| B、1L溶液中含有K+、SO42-总数为0.1NA |
| C、1 L溶液中K+的浓度是0.05 mol?L-1 |
| D、2 L溶液中含有SO42-的浓度是0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、对于△H<0,△S>0的反应,不仅能自发进行,反应速率也很快 |
| D、S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com