
| A. | 3:2:4:1 | B. | 1:1:1:1 | C. | 2:1:2:1 | D. | 1:2:1:2 |
分析 (l)KClO3和MnO2共热,发生2KClO3$\frac{\underline{催化剂}}{△}$2KCl+3O2↑,生成3molO2转移电子是12mol;
(2)H2O2中加MnO2,发生2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,生成1molO2转移电子是2mol;
(3)KMnO4受热分解,发生2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,生成1molO2转移电子是4mol;
(4)Na2O2和水发生2Na2O2+2H2O═4NaOH+O2↑,生成1molO2转移电子是2mol,以此解答该题.
解答 解:(l)KClO3和MnO2共热,发生2KClO3$\frac{\underline{催化剂}}{△}$2KCl+3O2↑,生成3molO2转移电子是12mol,生成1molO2转移电子是4mol;
(2)H2O2中加MnO2,发生2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,生成1molO2转移电子是2mol;
(3)KMnO4受热分解,发生2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,生成1molO2转移电子是4mol;
(4)Na2O2和水发生2Na2O2+2H2O═4NaOH+O2↑,生成1molO2转移电子是2mol,若制得相同质量的O2,反应中上述各种物质的电子转移数目之比是4mol:2mol:4mol:2mol=2:1:2:1,
故选C.
点评 本题考查氧化还原反应及计算,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 根据要求回答问题:
根据要求回答问题: .
. .分子中可能处于同一平面上的碳原子最多有4个.
.分子中可能处于同一平面上的碳原子最多有4个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Z>X | B. | 单质熔点:W>Z | ||
| C. | 最高正价:W>X>Y>Z | D. | 原子序数:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 提取碘水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度比水中大 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 纯碱的热稳定性大于碳酸氢铵 |
| C | 分离KNO3和NaCl | 重结晶 | 硝酸钾的溶解度大于氯化钠 |
| D | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯密度大于乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
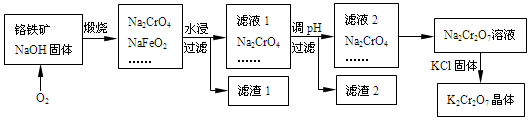
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
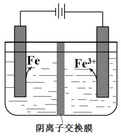
| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com