
 CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);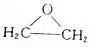 ,写出D和H2O反应生成E的化学方程式
,写出D和H2O反应生成E的化学方程式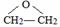 +H2O$\stackrel{一定条件}{→}$HOCH2CH2OH;
+H2O$\stackrel{一定条件}{→}$HOCH2CH2OH; ;
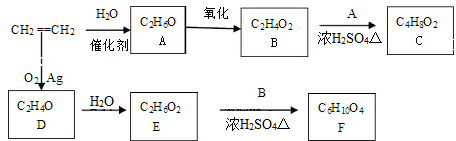
;分析 乙烯与水加成生成A为CH3CH2OH,乙醇催化氧化生成B为CH3COOH,乙酸与乙醇反应生成C为CH3COOC2H5,乙烯与氧气反应生成D(C2H4O),D的结构简式为 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为HOOCH2CH2OOH,F为二乙酸乙二酯
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为HOOCH2CH2OOH,F为二乙酸乙二酯 .
.
解答 解:乙烯与水加成生成A为CH3CH2OH,乙醇催化氧化生成B为CH3COOH,乙酸与乙醇反应生成C为CH3COOC2H5,乙烯与氧气反应生成D(C2H4O),D的结构简式为 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为HOOCH2CH2OOH,F为二乙酸乙二酯
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为HOOCH2CH2OOH,F为二乙酸乙二酯 .
.
(1)由上述分析可知,A是乙醇,故答案为:乙醇;
(2)B和A反应生成C是乙酸与乙醇反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应),
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应),
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,酯化反应(或取代反应);
CH3COOC2H5+H2O,酯化反应(或取代反应);
(3)D+H2O→E的方程式为: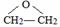 +H2O$\stackrel{一定条件}{→}$HOCH2CH2OH,
+H2O$\stackrel{一定条件}{→}$HOCH2CH2OH,
故答案为: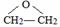 +H2O$\stackrel{一定条件}{→}$HOCH2CH2OH,
+H2O$\stackrel{一定条件}{→}$HOCH2CH2OH,
(4)由上述分析可知,F的结构简式为: ,
,
故答案为: ;
;
(5)D为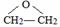 ,同分异构体的结构简式为CH3CHO,
,同分异构体的结构简式为CH3CHO,
故答案为:CH3CHO.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质,熟练掌握官能团的性质与转化,是对有机化合物知识的综合考查,难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
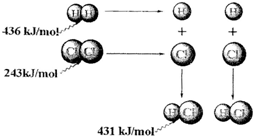
| A. | 氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量 | |
| B. | 436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量 | |
| C. | 431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量 | |
| D. | 氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W、M、N的原子半径的大小关系为:N>M>W>Y>Z>X | |
| B. | X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | 由X、W、M、N四种元素形成的化合物的溶于水,水溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
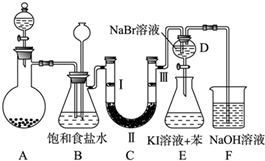
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气和氯气都需要先检验纯度 | B. | 都有火焰 | ||
| C. | 都放出热量 | D. | 都是氢元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
 ,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D、E | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | C、D、E、B、A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
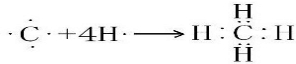 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com