
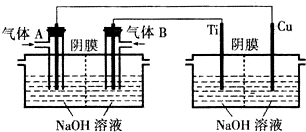
·ÖĪö ±¾ĢāĢ½¾æČČ»¹Ō·Ø”¢µē½ā·Ø¼°øÉ·Ø»¹Ō·ØÖʱøCu20µÄŌĄķ£¬ĘäÖŠČČ»¹Ō·ØŹĒ¼ÓČČĢõ¼žĻĀ£¬ĄūÓĆŅŗĢ¬ėĀ£ØN2H4£©»¹ŌŠĀÖʵÄCu£ØOH£©2ÖʱøCu20£¬Ķ¬Ź±ĻČŹĒµŖĘų£»µē½ā·ØŹĒĄūÓĆĒāŃõČ¼ĮĻµē³ŲÓĆĶ×÷Ńō¼«µē½āĒāŃõ»ÆÄĘČÜŅŗÖʵĆCu20£¬Ķ¬Ź±»¹æ¼²éĮĖÓŠ¹Ųµē»ÆѧĄķĀŪ£¬Čēµē¼«·“Ó¦Ź½”¢ŅõĄė×ÓµÄ×ŖŅĘ¼°µē¼«µÄÅŠ¶ĻµČ£»øÉ·Ø»¹Ō·ØŹĒĄūÓĆ·“Ó¦Cu+CuO$\frac{\underline{\;øßĪĀ\;}}{\;}$Cu2OŅ²æÉÖʱøCu20£¬ÖŲµćæ¼²éµÄŹĒŃõ»Æ»¹Ō·“Ó¦µÄ·ÖĪö¼°ŌĖÓĆĪļÖŹµÄĮæ½ųŠŠµÄ¼ĘĖć£»
£Ø1£©ŌŚ¼ÓČČĢõ¼žĻĀ£¬ÓĆŅŗĢ¬ėĀ£ØN2H4£©»¹ŌŠĀÖʵÄCu£ØOH£©2ÖʱøCu20£¬Ķ¬Ź±·Å³öN2£¬½įŗĻÖŹĮæŹŲŗć¶ØĀÉŗĶŃõ»Æ»¹Ō·“Ó¦æÉŠ“³ö“Ė·“Ó¦µÄ»Æѧ·½³ĢŹ½£»
£Ø2£©¢Łµē½ā³ŲÖŠĶĪŖŃō¼«£¬AĪŖŌµē³ŲµÄÕż¼«£¬ĘųĢåAĪŖŃõĘų£¬¼īŠŌĒāŃõČ¼ĮĻµē³ŲÖŠ£¬Õż¼«ÉĻŃõĘųµĆµē×Ó·¢Éś»¹Ō·“Ó¦£»
¢ŚŌµē³ŲÖŠ£¬ŅõĄė×ÓĻņøŗ¼«ŅĘ¶Æ£»µē½ā³ŲµÄŃō¼«ŹĒĶµē¼«±»Ńõ»Æ£¬æÉøł¾ŻŃō¼«ÖÜĪ§µÄ¼īŠŌ»·¾³¼°µē½ā²śĪļĄ“ŹéŠ“µē¼«·“Ó¦Ź½£»
¢Ūµē½ā³ŲÖŠ·¢ÉśµÄ×Ü·“Ó¦Ź½ĪŖ2Cu+H2O$\frac{\underline{\;µē½ā\;}}{\;}$Cu20+H2”ü£¬øł¾Żµē½āŹ²Ć“²¹Ź²Ć“µÄŌŌņ£¬æÉÖŖŠčŅŖ²¹³äµÄĪļÖŹ£»
¢ÜČ¼ĮĻµē³ŲĻūŗĵďĒŃõĘųŗĶĒāĘų£¬µē½ā³ŲÄŚČܽāĶ£¬Ķ¬Ź±µĆµ½ĒāĘų£¬æÉÖŖæÉŃ»·ĄūÓƵÄĪļÖŹĪŖĒāĘų£»
£Ø3£©¶čŠŌµē¼«µē½āĀČ»ÆĶ£¬Ńō¼«µē¼«·“Ó¦ĪŖ2Cl--2e-=Cl2”üŗĶ4OH--4e-=O2”ü+2H2O£»£¬Ņõ¼«µē¼«·“Ó¦ĪŖ£ŗCu2++2e-=CuŗĶ2H++2e-=H2£¬ŅĄ¾Żµē×ÓŹŲŗćŗĶµē¼«·“Ó¦½įŗĻCuCl2ČÜŅŗÖŠČÜÖŹµÄĪļÖŹµÄĮæ¼ĘĖćŃō¼«æɵƵ½²śĪļµÄÖŹĮ森
½ā“š ½ā£ŗ£Ø1£©øł¾Ż·“Ó¦ĪļN2H4ŗĶCu£ØOH£©2£¬Éś³ÉĪļŹĒCu20”¢H2OŗĶN2£¬æɵƻÆѧ·½³ĢŹ½ĪŖ4Cu£ØOH£©2+N2H4$\frac{\underline{\;¼ÓČČ\;}}{\;}$N2”ü+2Cu2O+6H2O£¬
¹Ź“š°øĪŖ£ŗ4Cu£ØOH£©2+N2H4$\frac{\underline{\;¼ÓČČ\;}}{\;}$N2”ü+2Cu2O+6H2O£»
£Ø2£©¢ŁČ¼ĮĻµē³ŲĶØŃõĘųµÄ¼«ĪŖÕż¼«£¬Į¬½Óµē½ā³ŲŃō¼«£ØĶµē¼«£©µÄ¼«ĪŖÕżČ·£¬æÉÖŖĘųĢåAĪŖŃõĘų£¬¼īŠŌĒāŃõČ¼ĮĻµē³ŲÖŠ£¬Õż¼«ÉĻŃõĘųµĆµē×ÓŗĶĖ®·“Ӧɜ³ÉĒāŃõøłĄė×Ó£¬µē¼«·“Ó¦Ź½ĪŖO2+2H2O+4e-=4OH-£¬
¹Ź“š°øĪŖ£ŗO2+2H2O+4e-=4OH-£»
¢ŚŌµē³ŲÄŚŅõĄė×ÓĻņøŗ¼«ŅĘ¶Æ£¬¹ŹČ¼ĮĻµē³ŲÄŚOH-µÄŅĘ¶Æ·½ĻņĪŖ“Ó×óĻņÓŅ£¬µē½ā³ŲŃō¼«ŹĒĶ±»Ńõ»Æ£¬µē¼«·“Ó¦Ź½ĪŖ2Cu+2OH--2e-=Cu2O+H2O£¬
¹Ź“š°øĪŖ£ŗÓÉ×óĻņÓŅ£»2Cu+2OH--2e-=Cu2O+H2O£»
¢Ūµē½ā³ŲÄŚ·¢ÉśµÄ×Ü·“Ó¦Ź½ĪŖ2Cu+H2O$\frac{\underline{\;µē½ā\;}}{\;}$Cu20+H2”ü£¬æÉÖŖŠčŅŖ²¹³äµÄĪļÖŹŹĒĖ®£¬
¹Ź“š°øĪŖ£ŗH2O£»
¢Üµē½ā³ŲŅõ¼«µĆµ½µÄĒāĘųæɲ¹³äČ¼ĮĻµē³ŲĻūŗĵÄĒāĘų£¬æɼūæÉŃ»·µÄĪļÖŹĪŖĒāĘų£¬
¹Ź“š°øĪŖ£ŗH2£»
£Ø3£©ĄūÓĆĒāŃõČ¼ĮĻµē³Ų£¬µē½ā50mL 2mol/LµÄCuCl2ČÜŅŗ£ØĮ½µē¼«ĪŖ¶čŠŌµē¼«£©£¬µ±ĻūŗıźæöĻĀ6.72LĒāĘųŹ±£¬n£ØH2£©=$\frac{6.72L}{22.4L/mol}$=0.3mol£¬n£ØCuCl2£©=0.05L”Į2mol/L=0.1mol£¬¹ŹŃō¼«²śĪļĪŖCl2ŗĶO2£®øł¾Żµē×ÓŹŲŗćæÉµĆ£ŗn£ØCl2£©=0.05L”Į2mol/L=0.1molŗĶn£ØO2£©=$\frac{0.3mol”Į2-0.1mol”Į2}{4}$=0.1mol£¬¹Źµē½ā³ŲµÄŃō¼«æɵƵ½²śĪļµÄÖŹĮæĪŖ£ŗ0.1mol”Į71g/mol+0.1mol”Į32g/mol=10.3g£¬¹Ź“š°øĪŖ£ŗ10.3£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦ŌĄķ”¢µē»ÆѧĄķĀŪ”¢»ģŗĻĪļµÄ¼ĘĖć”¢ŹŲŗć¼ĘĖćµČ£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č··“Ó¦¹ż³ĢŹĒ½āĢāµÄ¹Ų¼ü£¬¼ĘĖćĢā²ÉČ”²š·Ö·Ø½ā“š£¬¼ņ»Æ¼ĘĖć¹ż³Ģ£¬×¢ŅāŌŚŃ§Ļ°ÖŠ¹éÄÉ×ܽį£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«Ķ²åČėĻõĖįŅųČÜŅŗÖŠ£ŗCu+Ag+ØTCu2++Ag | |
| B£® | Ca£Ø HCO3£©2 ČÜŅŗÓė¹żĮæ NaOH ČÜŅŗ·“Ó¦£ŗHCO3-+OH-+Ca2+ØTCaCO3”ż+H2O | |
| C£® | ÓĆŹ³“׳żĖ®¹ø£ŗCaCO3+2CH3COOHØTCa2++2CH3COO-+CO2”ü+H2O | |
| D£® | Ļ”ĮņĖįŗĶBa£ØOH£©2ČÜŅŗ·“Ó¦£ŗH++SO42-+Ba 2++OH-ØTBaSO 4”ż+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| t/s | 0 | 50 | 150 | 250 | 350 |
| n£ØPCl3£©/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A£® | ·“Ó¦ŌŚĒ°50 sµÄĘ½¾łĖŁĀŹĪŖv£ØPCl3£©=0.0016mol•L-1•s-1 | |
| B£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±£¬c£ØPCl3£©=0.11mol•L-1£¬Ōņ·“Ó¦µÄ”÷H£¾0 | |
| C£® | ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė1.0 molPCl5”¢0.20 molPCl3ŗĶ0.20 molCl2£¬“ļµ½Ę½ŗāĒ°v£ØÕż£©£¾v£ØÄę£© | |
| D£® | ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2.0 molPCl3”¢2.0 molCl2£¬“ļµ½Ę½ŗāŹ±£¬PCl3µÄ×Ŗ»ÆĀŹŠ”ÓŚ80% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
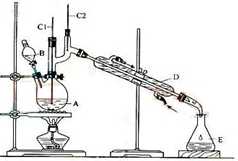 Õż¶”Č©ŹĒŅ»Öֻƹ¤ŌĮĻ£®Ä³ŹµŃ銔×éĄūÓĆČēĶ¼×°ÖĆŗĻ³ÉÕż¶”Č©£®
Õż¶”Č©ŹĒŅ»Öֻƹ¤ŌĮĻ£®Ä³ŹµŃ銔×éĄūÓĆČēĶ¼×°ÖĆŗĻ³ÉÕż¶”Č©£®| ·Šµć/”ę | ĆܶČ/£Øg•cm-3£© | Ė®ÖŠČܽāŠŌ | |
| Õż¶”“¼ | 117.72 | 0.8109 | Ī¢ČÜ |
| Õż¶”Č© | 75.7 | 0.8017 | Ī¢ČÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
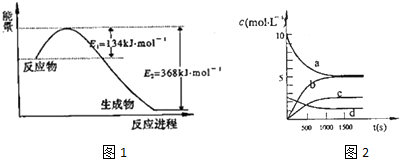
| t£Øs£© | 0 | 500 | 1000 | 1500 |
| n£ØNO2£©£Ømol£© | 20 | 13.96 | 10.08 | 10.08 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | x£ŗy=3£ŗ1 | B£® | v£ØA£©£ŗv£ØC£©=2£ŗ1 | ||
| C£® | AµÄĘ½ŗāÅضČĪŖ0.4mol/L | D£® | AÓėBµÄĘ½ŗāÅضČÖ®±ČĪŖ3£ŗ2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com