
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:高温分解FeSO4,利用如图1所示的实验装置进行实验.
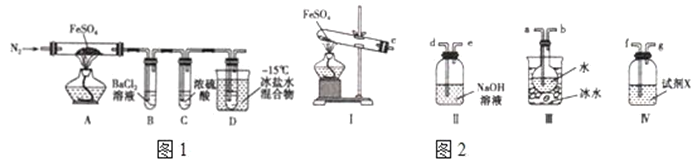
已知:①SO2熔点为﹣72℃,沸点为﹣10℃;
②SO3熔点为﹣16.8℃,沸点为44.8℃。
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是__________________________。
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为______,同时有两种无色气体生成,写出该反应的化学方程式_________________________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是___,将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是__________________________。
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品________________________________________________________________。
【答案】排除装置中的空气 红棕色 2FeSO4![]() Fe2O3+SO2↑+SO3↑ Fe2O3+6H+=2Fe3++3H2O 2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ 在最后加一个盛碱石灰的干燥管或NaOH溶液;
Fe2O3+SO2↑+SO3↑ Fe2O3+6H+=2Fe3++3H2O 2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ 在最后加一个盛碱石灰的干燥管或NaOH溶液;
【解析】
(1)通入氮气的目的是排除装置中的空气;
(2)根据题意同时有两种无色气体生成,B中有白色沉淀,则两种气体可能为二氧化硫和三氧化硫,根据化合价的改变,则还有Fe2O3;
(3)Fe2O3与盐酸反应生成氯化铁和水;将反应后所得溶液(氯化铁)滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,据此写出离子方程式;
(4)考虑D装置连接空气,该反应需要排除空气中二氧化碳和水与D中二氧化硫反应。
(1)通入氮气的目的是排除装置中的空气;
答案是:排除装置中的空气;
(2)B中有白色沉淀,可能为硫酸钡或者亚硫酸钡,有两种无色气体生成,则应为二氧化硫和三氧化硫,硫元素化合价降低,则铁元素化合价升高为三氧化二铁,红棕色;该反应的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑ ;
Fe2O3+SO2↑+SO3↑ ;
答案是:红棕色;2FeSO4![]() Fe2O3+SO2↑+SO3↑ ;
Fe2O3+SO2↑+SO3↑ ;
(3) Fe2O3与盐酸反应的离子方程式为: Fe2O3+6H+=2Fe3++3H2O ;将反应后所得溶液滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;
答案是: 2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ ;
(4)最后的D装置连接了空气,需排除空气的影响,在D的后面加一个吸收二氧化碳和水的装置,以防与D中的二氧化硫反应,装置内试剂可以是碱石灰或NaOH溶液;
答案是:在最后加一个盛碱石灰的干燥管或NaOH溶液。


科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=_______________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________________________________。
(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol/L | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol/L | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①0~5min,用NO2的浓度变化表示的反应速率为_________________。
②以下表述能说明该反应己达到平衡状态的是________。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡_______(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _________________。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移6mol电子
C. AlN属于离子化合物,其中氮元素的化合价为+3
D. AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原溶液中Al2(SO4)3和MgSO4的物质的量之比为
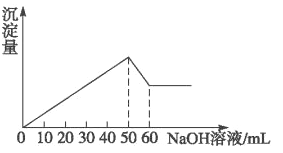
A. 1 :2B. 3 : 1C. 3 : 2D. 2 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:_____________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2 中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2 为________(填“正盐”或“酸式盐”),其溶液显 ________(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯,如图所示实验装置:

请回答下列问题:
(1)能完成本实验的装置是 __________________(从甲、乙、丙中选填)
(2)试管B中装入的液体为 ______________。
(3)制取乙酸乙酯时加入试剂顺序为_____________________,发生反应的化学方程式为 __________________________________________。
(4)从制备乙酸乙酯所得的混合物中分离、提纯乙酸乙酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
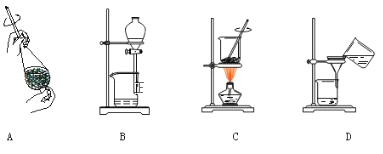
(5)用30g乙酸和40g乙醇反应,可以得到37.4g乙酸乙酯,则该实验的产率(产率指的是某种生成物的实际产量与理论产量的比值)是 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. SO3与SO2 B. BF3与NH3 C. BeCl2与SCl2 D. H2O与SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据地球化学分析,地壳中存在量较大的9种元素含量如图所示(含量最高的四种元素用字母代号表示)。下列说法正确的是( )
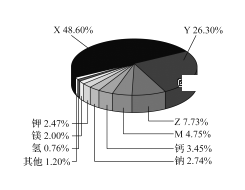
A. X为硅元素,M为铁元素
B. 地壳中有游离态的Y元素和M元素
C. Z和M的氧化物均属于碱性氧化物
D. Z的单质通过置换反应可制取M的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com