
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 v(Z)=0.01mol•(L•min)-1,以W的浓度变化来表示的反应速率=$\frac{0.2mol}{2L×5min}$=0.02mol•(L•min)-1,化学计量数与反应速率成正比,据此计算n.
解答 解:(1)5min末已生成0.2mol W,则v(W)=$\frac{0.2mol}{2L×5min}$=0.02mol•(L•min)-1,
则v(Z):v(W)=0.01mol•(L•min)-1:0.02mol•(L•min)-1=n:2,解得n=1,
故选A.
点评 本题考查了化学反应速率的计算,题目难度不大,掌握掌握化学反应速率的概念及计算方法,明确反应速率与化学计量数成正比是解答本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 将干燥的氯气与红色鲜花充分接触 | B. | 将H2 02加入到KMnO4溶液中 | ||
| C. | 将足量SO2通入紫色石蕊试液中 | D. | 将漂白液加入到Fe2(SO4)3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | Fe3++3H2O?Fe(OH)3+3H+ | ||
| C. | HS-+H2O?H2S+OH- | D. | CH3COOH?CH3COO-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO | |
| B. | SO2和湿润的C12都有漂白性,推出二者混合后漂白性更强 | |
| C. | Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同 | |
| D. | CuCl2溶液与H2S可以生成CuS沉淀,推出FeCl2溶液也可与H2S生成FeS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下将28 g Fe投人到足量的浓硝酸中,可得到标准状况下33.6 L NO2 | |
| B. | 任何条件下,64 gSO2中含有的原子数目一定为3 NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA | |
| D. | 1 mo1 Na2O2反应生成O2时,必失去2 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2与18O2互为同素异形体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O和18O互为同位素 | |
| D. | 1.12L16O2和 1.12L18O2均含有0.1 NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

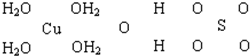
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com