
| A. | CO2的摩尔质量为44g | |
| B. | 1 mol N2的质量是14g | |
| C. | 标准状况下,1 mol CO2所占的体积约是22.4L | |
| D. | 将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L |
分析 A.摩尔质量单位为g/mol;
B.氮气的摩尔质量为28g/mol,m=nM;
C.一定温度和压强下,气体摩尔体积是单位物质的量的气体所占气体的体积,标准状况下1mol任何气体所占体积约为22.4L;
D.溶液体积不是1L.
解答 解:A.摩尔质量单位为g/mol,CO2的摩尔质量为44g/mol,故A错误;
B.氮气的摩尔质量为28g/mol,1 mol N2的质量m=nM=1mol×28g/mol=28g,故B错误;
C.标准状况下,1 mol CO2所占的体积约是22.4L,故C正确;
D.溶液体积不是1L,将40g NaOH物质的量为1mol,溶于1L水中,溶液体积大于1L,所得溶液的物质的量浓度小于1mol/L,故D错误;
故选C.
点评 本题考查了摩尔质量、气体摩尔体积、质量和物质的量的换算,题目较简单.


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
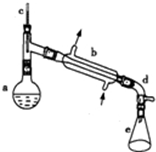 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
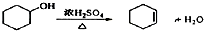 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
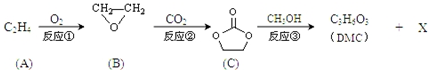
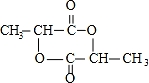 ;
;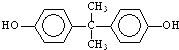 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n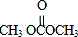 +n
+n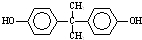 →
→ +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:
过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2ml0.3mol/L的硅酸钠溶液中滴入稀盐酸所制得的硅酸胶体中胶粒的数目为0.0006NA | |
| B. | 常温下,1LpH=2的H2S溶液中H+的数目为0.01NA | |
| C. | 1mol铁粉与22.4L(标准状况)氯气充分反应,转移的电子数是3NA | |
| D. | 常温常压下,2.8gC4H8中有1.2NA的共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在分子组成上相差一个或若干个CH2原子团的物质一定互称为同系物 | |
| B. | 具有同分异构现象的有机化合物互称为同分异构体 | |
| C. | 同素异形体是指同种元素形成不同的单质 | |
| D. | 含有相同的质子数而不同的中子数的同一类元素的原子互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L 甲醇完全燃烧后生成的 CO2 分子个数约为$\frac{1}{2.42}$N A | |
| B. | N A个H2分子的质量约为2g,它所占的体积约为 22.4L | |
| C. | 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为N A | |
| D. | 500mL 0.5mol/L 的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com