
| m |
| M |
| m |
| M |
| n |
| V |
| 10g |
| 40g/mol |
| 1000ρω |
| M |
| 1.6g |
| 16g/mol |
| 38.5g |
| 85g/mol |
| 0.45mol |
| 0.15L |
| 10g |
| 40g/mol |
| 10g |
| 10g+45g |
| 10 |
| 55 |
1000×1×
| ||
| 40 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11:2 | B、9:2 |
| C、2:11 | D、2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、AlO2-、NO3-、Cl- |
| B、CrO42-、H+、K+、NO3- |
| C、Ba2+、Na+、HCO3-、OH- |
| D、K+、SO42-、S2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4固体与试管中,加入一定量水溶解. | \ |
| 步骤二: |
查看答案和解析>>
科目:高中化学 来源: 题型:
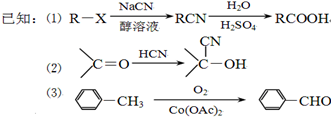
 ):
):
| H2O |
| H2SO4 |
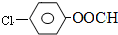 结构,则符合此条件的F共有
结构,则符合此条件的F共有查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com