
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于________(选填编号)。
a.主族元素 b.副族元素 c.Ⅶ族元素 d.过渡元素
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
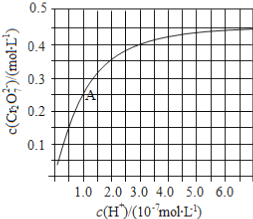
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“>”“<”或“=”)。
(3)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
某含铬废水处理的主要流程如图所示:
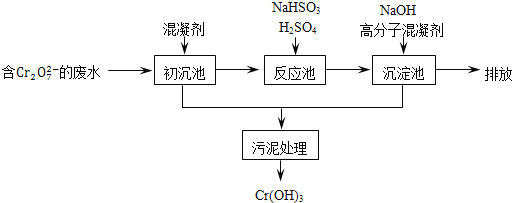
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________.证明Cr3+沉淀完全的方法是__________.
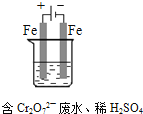
(4)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g.
【答案】 bd 2CrO42-+2H+![]() Cr2O72- +H2O 增大 K=1.0×1014 < Al3+ + 3H2O
Cr2O72- +H2O 增大 K=1.0×1014 < Al3+ + 3H2O![]() Al(OH)3(胶体) + 3H+ Cr2O72- +3HSO3- +5H+===2Cr3++3SO42- +4H2O H+、Cr3+ 测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全(其他合理答案均可) 6Fe2++Cr2O72- +14H+===6Fe3++2Cr3++7H2O 8.48
Al(OH)3(胶体) + 3H+ Cr2O72- +3HSO3- +5H+===2Cr3++3SO42- +4H2O H+、Cr3+ 测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全(其他合理答案均可) 6Fe2++Cr2O72- +14H+===6Fe3++2Cr3++7H2O 8.48
【解析】(1)Cr是ⅥB族的金属元素,所以是副族元素也是过渡元素。
(2)①图中看到:酸性增强时CrO42转化为Cr2O72,所以方程式为:2CrO42+2H+![]() Cr2O72- +H2O。②酸性增强,氢离子浓度增大,平衡正向移动,CrO42的平衡转化率增大。A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L - 0.25mol/L×2 = 0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为
Cr2O72- +H2O。②酸性增强,氢离子浓度增大,平衡正向移动,CrO42的平衡转化率增大。A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L - 0.25mol/L×2 = 0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 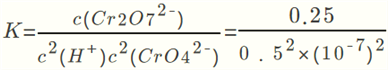 ,即K=1×1014。③升高温度,溶液中CrO42的平衡转化率减小,说明平衡逆向移动,则该反应的ΔH<0。
,即K=1×1014。③升高温度,溶液中CrO42的平衡转化率减小,说明平衡逆向移动,则该反应的ΔH<0。
(3)①加入明矾的目的是铝离子水解得到氢氧化铝胶体,再吸附水中其他不溶物一起聚沉,所以反应为:Al3+ + 3H2O![]() Al(OH)3(胶体) + 3H+。
Al(OH)3(胶体) + 3H+。
②用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,同时+4价S化合价应该升高到+6价,得到硫酸根根,所以方程式为:Cr2O72- +3HSO3- +5H+===2Cr3++3SO42- +4H2O。沉淀池溶液中主要存在氢离子和Cr3+,加入氢氧根离子,应该先进行酸碱中和,再形成氢氧化铬沉淀,所以先反应H+再反应Cr3+。从题目的表格中已知:pH达到8的时候溶液中的Cr3+完全沉淀,所以可以利用测定溶液pH的方法来证明Cr3+完全沉淀。
(4)Cr2O72-将Fe2+氧化为Fe3+,本身还原为Cr3+,所以反应方程式为:6Fe2++Cr2O72- +14H+===6Fe3++2Cr3++7H2O。根据上述方程式,处理该溶液中0.01molCr2O72-时,应该得到0.02molCr3+和0.06molFe3+,题目说得到的金属阳离子在阴极区可沉淀完全,则Cr3+和Fe3+应该完全沉淀,得到0.02molCr(OH)3和0.06molFe(OH)3,质量为0.02×(52+17×3) + 0.06×(56+17×3)=8.48g。


科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
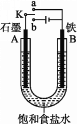
(1)若开始时开关K与a连接,则B极的电极反应为____________________。
(2)若开始时开关K与b连接,则B极的电极反应为____________________,总反应的离子方程式为____________________。
(3)有关上述实验,下列说法正确的是______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
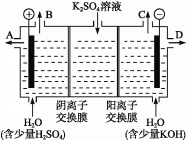
①该电解槽的阳极反应为______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃按沸点由高到低顺序排列正确的是( )
①正丁烷②异丁烷③正戊烷④异戊烷⑤新戊烷
A.①②③④⑤B.⑤④③②①C.③①⑤④②D.③④⑤①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣═H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.二氧化碳通入澄清石灰水中
D.澄清石灰水和稀硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为化合物,且其摩尔质量为95g·mol-1,D为混合物,M是一种常见的气体,N是一种常见金属单质。它们之间的转化如图所示。
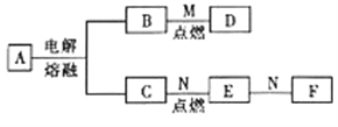
请回答下列问题:
(1)A的化学式为___________。
(2)由A生成B和C的反应中,每转移1mol电子,可以生成________gB。
(3)已知D中含有两种固体,且其中有一种固体单质为黑色,另一种固体为B的氧化物。则M的摩尔质量为_________g·mol-1。
(4)E的水溶液与N反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二甲醚和乙醇是同分异构体,下列鉴别方法中不可行的是 ( )
A. 利用金属钠 B. 利用质谱法
C. 利用红外光谱法 D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液。室温条件下,有关上述溶液的比较中,正确的是( )
A. 水电离的c(H+):①=②=③=④
B. 将②、④溶液混合后,pH=7,消耗溶液的体积:②<④
C. 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D. 向10 mL上述四溶液中各加入90 mL水后,溶液的pH:③>④>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中常用到化学知识,下列说法不正确的是( )
A. 白色污染、绿色食品中的“白”、“绿”均指相关物质的颜色
B. 用食醋可以除去热水壶中的水垢
C. 聚氯乙烯塑料有毒,不可用于制食品包装袋
D. 新制的Cu(OH)2可以检测糖尿病患者尿液中是否含有葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com