
 碳酸钠一过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠一过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:分析 (1)第1步中,稳定剂与水反应生成2种常见的难溶物,则生成氢氧化镁和硅酸,根据反应物和生成物书写反应方程式;
(2)反应保持为15℃左右可采取的措施有15℃水浴或冷水浴;
(3)根据相似相溶原理分析;
(4)①根据各仪器的作用选取仪器;
②滴定终点观察到的现象是溶液呈浅红色且30s内不褪色;
(5)①根据仪器的感量与量取溶液的体积选取仪器;
②为确保生成的二氧化碳被氢氧化钠溶液完全吸收应防止漏气,且使仪器中的二氧化碳都进入氢氧化钠溶液中;
③为获得样品中碳酸钠的含量,还要知道氢氧化钠溶液的浓度.
解答 解:(1)第1步中,稳定剂与水反应生成2种常见的难溶物,则生成氢氧化镁和硅酸,根据元素守恒知,还生成氯化钠,根据反应物和生成物知,该反应方程式为:MgCl2+Na2SiO3+2H2O=2NaCl+Mg(OH)2↓+H2SiO3↓,
故答案为:MgCl2+Na2SiO3+2H2O=2NaCl+Mg(OH)2↓+H2SiO3↓;
(2)反应保持为15℃左右可采取的措施有15℃水浴或冷水浴,
故答案为:15℃水浴或冷水浴;
(3)根据相似相溶原理知,碳酸钠-过氧化氢在有机溶剂中的溶解度较小,为降低碳酸钠-过氧化氢的溶解度,选用无水乙醇作溶剂,
故答案为:降低过碳酸钠的溶解度,有利于晶体析出;
(4)①配制一定物质的量浓度的溶液需要(250 mL)容量瓶,起定容作用的胶头滴管,
故答案为:(250 mL)容量瓶,胶头滴管;
②当溶液呈浅红色且30 s内不褪色时达到滴定终点,所以滴定终点观察到的现象是溶液呈浅红色且30 s内不褪色,
故答案为:溶液呈浅红色且30 s内不褪色;
(5)①准确移取40.00mL氢氧化钠溶液需要的仪器是碱式滴定管,故答案为:碱式滴定管;
②步骤1~7中,确保生成的二氧化碳被氢氧化钠溶液完全吸收的实验步骤有:防止漏气,为防止烧瓶中溶液溶解二氧化碳,要将溶液加热,为防止烧瓶中含有二氧化碳,用氮气将烧瓶内的二氧化碳赶到氢氧化钠溶液,
故答案为:1,5,6;
③为获得样品中碳酸钠的含量,还需要知道氢氧化钠的浓度,所以还需补充的实验是用H2SO4标准溶液标定NaOH溶液的浓度,
故答案为:用H2SO4标准溶液标定NaOH溶液的浓度.
点评 本题考查制备实验方案设计,涉及滴定实验、仪器的选取、基本操作、物质分离和提纯等知识点,明确实验原理及实验基本操作、物质性质是解本题关键,知道容量瓶选取方法、滴定管的使用方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
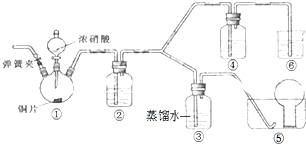 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com