
【题目】用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

(1)用KSCN溶液检验出Fe3+的现象是_______________________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _____________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:

①NaCl溶液的浓度是________ mol·L-1。
②Ⅳ中检测Cl2的实验方法:______________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________。
【答案】溶液变红 2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl- 还原 0.2 取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝 通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了Fe2+先于Cl-放电
【解析】
(1)依据溶液中的Fe3+的检验方法与原理回答;
(2)依据电解原理书写阳极氯离子失电子的电极反应,生成的Cl2能将Fe2+氧化为Fe3+,据此写出离子方程式;
(3)阳极可发生氧化反应,依据氧化还原规律分析;
(4)①保证电解FeCl2与NaCl时溶液中c(Cl-)相同;
②利用淀粉KI试纸可检验氯气的存在;
③依据对照思想,找出产生上述现象的因素,结合电解原理中电解质溶液的离子放电顺序作答。
(1)SCN-与Fe3+发生反应生成Fe(SCN)3而使溶液变成红色,常根据这一颜色变化检验溶液中的Fe3+,
故答案为:溶液变红;
(2)实验Ⅰ中阳极附近出现黄色,有气泡产生,则该气体应为Cl2,Cl2将Fe2+氧化成Fe3+,有关反应为2Cl--2e-===Cl2↑,Cl2+2Fe2+===2Cl-+2Fe3+,
故答案为:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-;
(3)电解过程中,阳极发生氧化反应,由于Fe2+具有还原性,若其浓度较大,可能在阳极失去电子发生氧化反应生成Fe3+,
故答案为:还原。
(4)①pH=1的0.1 mol·L-1的FeCl2溶液中,c(Cl-)=0.2mol·L-1,根据控制变量法的原理,必须保证电解时溶液中c(Cl-)相同,则pH=1的NaCl溶液中c(NaCl)应为0.2 mol·L-1,
故答案为:0.2;
②Cl2具有强氧化性,可取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝,
故答案为:取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝;
③对比实验Ⅱ和Ⅳ、Ⅴ可知,电极附近出现黄色可能是由于生成Fe3+、Cl2所致,通过控制电压,证明产生Fe3+的两种原因都成立,同时也验证了Fe2+先于Cl-放电,
故答案为:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了Fe2+先于Cl-放电。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s) + 2B(g)![]() C(g) + D(g) 已达到平衡状态‘
C(g) + D(g) 已达到平衡状态‘
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质检验是化学研究常用的方法之一。下列有关溶液成分的检验,结论不正确的是
A.若滴加酚酞溶液,溶液变红,原溶液不一定是碱溶液
B.若先滴加足量新制氯水,再滴加少量KSCN溶液,溶液变为血红色,则原溶液一定含有Fe2+
C.若滴加Na2CO3溶液,产生白色沉淀,则原溶液可能含有Ca2+
D.若滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原溶液中可能含CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
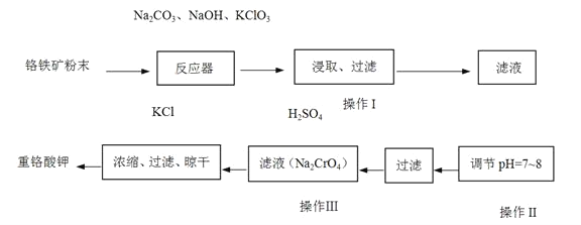
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备 Fe(OH)2。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂后应________(填“打开”或者“关闭”)止水夹,反应一会儿后应________(填“打开”或者“关闭”)止水夹。
II.某化学兴趣小组用下图装置制取并探究氯气的性质。[A装置中发生反应的化学方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2 + 5Cl2↑+ 8H2O ]

(1)A装置中a仪器的名称是_____________。
(2)实验室制氯气也可用MnO2与浓盐酸反应,化学方程式为:_____
(3)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,请用化学方程式表示其褪色原因__________。
(4)当氯气进入D装置后,可观察到溶液颜色变为____(填“红色”或“蓝色”),写出该反应的离子方程式为_________。
(5)E装置中反应的化学方程式为________。
(6)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_____L氯气。(KMnO4的摩尔质量为158 g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述正确的是( )
①用稀盐酸洗涤盛放过石灰水的试剂瓶
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③有六种分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阳离子的溶液,不能用NaOH溶液鉴别;
④用稀硝酸清洗做附着在试管表面的Ag单质;
⑤如果皮肤上不慎沾有浓硫酸,应立即用大量的NaOH稀溶液冲洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧某溶液加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,则原溶液中含NH4+。
A.①⑤⑦B.③④⑦⑧C.①②④⑧D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二,而云南钼的产量又居中国首位。钼及其合金在冶金、农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1:1,完成下列方程式:_____Mo+_____HF+_____HNO3=_____MoO2F2+_____MoOF4+_____NO2↑+__________
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②MoS2(s)+2O2(g)═Mo(s)+2SO2(g)△H2
③2MoS2(s)+7O2(g)═2MoO3(s)+4SO2(g)△H3
则ΔH3=_____(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_________mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理为以下所示化学方程式MoS2(s)+4H2(g)+2Na2CO3(s)═Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H
实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH_____0(填“>”或“<”);P2_____0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是_____选填编号)
A.V正(H2)=V逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达到平衡状态
D.容器内压强不变时,一定达到平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=_____(MPa)2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
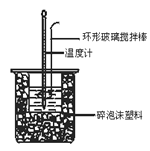
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
(方案l)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)图中球形干燥管的作用是__________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_____________。
(3)假设其他操作均正确,按照图装置将导致测定结果_______________(填“偏高”、“偏低”或“无影响”)。
(方案2)用图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
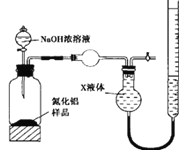
(4)为测定生成气体的体积,量气装置中的X液体最好选择________________。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.浓硫酸
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况)。则AlN的质量分数是___________________(需化简)。
(方案3)按下列路径测定样品中AlN的纯度:

(6)写出步骤反应的离子方程式_____________________。
(7)该方案能否测出AlN的纯度?(若能请用m1,m2列出计算纯度的表达式)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com