
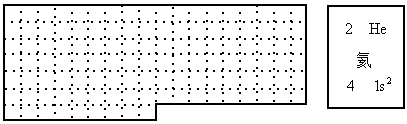
(1)上表中的实线是元素周期表的部分边界,请在表中用实线补全元素周期表边界.
(2)元素甲是第三周期,第ⅥA族元素,请在右边方框中按氦元素的式样写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布.

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:______>______.甲、乙的最高价氧化物的水化物的酸性强弱为_______>_______(用化学式表示).
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的_________,请写出元素周期表中的位置与元素原子结构的关系:_____________.
|
(1) (2) (3) 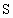 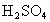 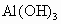
(4) 周期性变化 元素的周期数即为原子核外电子层数,元素的主族序数即为原子结构的最外层电子数思路分析: (A)(1)略 (2)图甲位于第三周期、第ⅥA族,则应是硫元素,答案为
(3) 因乙元素的3p亚层只有一个电子,即其电子排布式为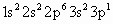 ,即乙元素是Al,其原子半径大于硫,甲、乙的最高价氧化物对应水化物分别为 ,即乙元素是Al,其原子半径大于硫,甲、乙的最高价氧化物对应水化物分别为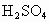 和 和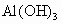 ,显然酸性前者强于后者.(4)元素周期律的本质是核外电子排布的周期性变化.因此元素周期表不是随意设定的,并且元素在周期表中的位置与原子结构密切相关,元素的周期数即为原子核外电子层数,元素所在主族序数即为原子结构的最外层电子数. ,显然酸性前者强于后者.(4)元素周期律的本质是核外电子排布的周期性变化.因此元素周期表不是随意设定的,并且元素在周期表中的位置与原子结构密切相关,元素的周期数即为原子核外电子层数,元素所在主族序数即为原子结构的最外层电子数. |
|
温馨提示:解答该题需要熟练掌握元素周期表的结构,原子结构的组成情况以及元素的周期性变化,掌握元素周期律的本质也是解答该类题目的关键. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


图
(1)上表中的实线是元素周期表的部分边界,请在表中用实线补全元素周期表的边界。
(2)元素甲是第三周期、第ⅥA族元素,请在下边方框中按氦元素(图)的式样写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:__________>__________。甲、乙的最高价氧化物水化物的酸性强弱为:_____________>___________(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的_____________,请写出元素在元素周期表中的位置与元素原子结构的关系:
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:


(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第3周期ⅥA族元素,请在下边方框中按氦元素(上图)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:______>______,甲、乙的最高价氧化物水化物的酸性强弱为:______>______。(用化学式表示)
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的_____,请写出元素在元素周期表中的位置与元素原子结构的关系:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(06年上海卷)(A)

(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________
甲、乙的最高价氧化物水化物的酸性强弱为:__________>__________(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表的位置与元素原子结构的关系。查看答案和解析>>
科目:高中化学 来源: 题型:
(06年上海卷)(A)

(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________
甲、乙的最高价氧化物水化物的酸性强弱为:__________>__________(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表的位置和元素原子结构的关系。查看答案和解析>>
科目:高中化学 来源: 题型:
23.(A)

(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在下边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:_____>_____甲、乙的最高价氧化物水化物的酸性强弱为:_____>_____(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的_________,请写出元素在元素周期表中的位置与元素原子结构的关系:
___________________________________________________
(B)
下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。

(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个。
元素③氢化物的电子式为_______。
(3)元素④一般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com