
【题目】元素R的原子序数是15,下列关于R元素的说法中,错误的是( )
A. R的最高正化合价是+5
B. R是第2周期第ⅤA族的元素
C. R的氢化物分子式是RH3
D. R的最高价氧化物对应的水化物的水溶液呈酸性
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法正确的是( )

A. 该未知溶液中至少含有4种阳离子
B. 滴加的NaOH溶液的物质的量浓度为0.5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的概念、性质说法正确的是( )
A.苯与甲苯属于同分异构体
B.苯与液溴在FeBr3催化作用下发生的反应属于取代反应
C.甲烷与Cl2在光照条件下发生的反应属于加成反应
D.乙醇与乙二醇( CH2OH-CH2OH) 属于同系物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有____________________。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
ⅰ锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
![]()
① 过程Ⅰ发生反应的化学方程式为______________________(SiO2+3C![]() SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
②整个制备过程必须严格控制无水。SiCl4遇水剧烈水解生成两种酸,反应的化学方程式是_________________________。
ⅱ 工业上也可以通过如下图所示的流程制取纯硅:
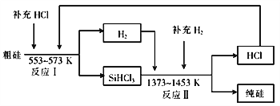
①有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_________;SiHCl3极易水解,其完全水解的化学方程式为___________________________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | ﹣30.4 | ﹣84.9 | ﹣111.9 |
② 假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Fe3+、Fe2+、Al3+、Na+的稀溶液中加入足量Na2O2固体,充分反应后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A. Fe3+ B. Al3+ C. Fe2+、 D. Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com