
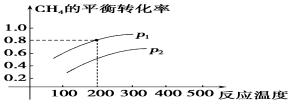
分析 ①由图可知,相同压强时,温度越高,甲烷的转化率越大;
②由反应可知,减小压强平衡正向移动,由图可知,相同温度时,p1对应的转化率较大;
③结合v=$\frac{△c}{△t}$计算.
解答 解:①由图可知,相同压强时,温度越高,甲烷的转化率越大,可知该反应为吸热反应,升高温度平衡正向移动,△H>0,
故答案为:>;温度越高,甲烷的转化率越大;
②由反应可知,减小压强平衡正向移动,由图可知,相同温度时,p1对应的转化率较大,则p1<p2,即该反应为气体体积增大的反应,压强越小、转化率越小,
故答案为:<;反应为气体体积增大的反应,压强越小、转化率越小;
③2L的密闭容器中,开始时为1mol的CH4,反应进行到5min时CH4的物质的量为0.5mol,0~5min内的反应速率v(H2)=$\frac{△c}{△t}$=$\frac{\frac{1mol-0.5mol}{2L}}{5min}$=0.05mol/(L.min),
故答案为:0.05mol/(L.min).
点评 本题考查化学平衡,为高频考点,把握图中温度、压强对平衡的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 | |
| D. | MgF2晶体中的化学键是共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(N2)>p(CH4)>p(CO2) | B. | p(CH4)>p(N2)>p(CO2) | C. | p(CH4)>p(CO2)>p(N2) | D. | p(CO2)>p(N2)>p(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物,非金属氧化物不一定是酸性氧化物 | |
| C. | 能够电离出H+的物质一定是酸 | |
| D. | 氧化钠和过氧化钠均能与酸反应生成盐和水,故二者都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cl2直接化合生成CuCl2;Cu与S直接化合也能得到CuS | |
| B. | Fe3O4可写成FeO•Fe2O3;Pb3O4也可写成PbO•Pb2O3 | |
| C. | Mg失火不能用CO2灭火;Na失火也不能用CO2灭火 | |
| D. | 工业上电解熔融MgCl2制取金属镁;也用电解熔融AlCl3的方法制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某反应的生成物总能量低于反应物总能量,则该反应为吸热反应 | |
| B. | 若A2+2D-=2A-+D2,则氧化性:D2>A2 | |
| C. | 若R2-和M+的电子层结构相同,则原子序数:R>M | |
| D. | 若甲、乙两种有机物具有相同的分子式,不同的结构,则甲和乙一定是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
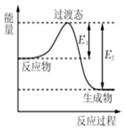 如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 活化能的大小决定了反应热的大小 | |
| C. | 该反应的活化能等于ykJ/mol | |
| D. | 1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)的△H=(x-y)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com