
| A. | 化学反应速率可用单位时间内反应物或生成物的物质的量的变化表示 | |
| B. | 硫代硫酸钠与酸反应,一定产生淡黄色的浑浊现象 | |
| C. | 相同物质的量浓度的硫代硫酸钠与稀盐酸反应,其他条件不变,盐酸浓度越大,产生淡黄色浑浊越快 | |
| D. | 相同物质的量浓度的硫代硫酸钠与稀硫酸反应,温度越高,产生淡黄色浑浊越快 |
分析 A.化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示;
B.根据硝酸具有强氧化性将硫元素氧化成硫酸根分析;
C.浓度越大,反应速率越大;
D.温度越高,反应速率越大.
解答 解:A.化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示,其公式为v=$\frac{△c}{△t}$,故A错误;
B.硝酸具有强氧化性将硫元素氧化成硫酸根,所以硫代硫酸钠与硝酸反应,不会产生淡黄色的浑浊现象,故B错误;
C.浓度越大,单位体积活化分子数目增多,则反应速率越大,产生淡黄色浑浊越快,故C正确;
D.温度越高,单位体积活化分子数目增多,则反应速率越大,产生淡黄色浑浊越快,故D正确;
故选CD.
点评 本题考查化学反应速率及其影响因素等有关知识,侧重考查影响因素,明确化学反应速率概念、影响因素等即可解答.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属晶体的熔点和沸点都很高 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2SO4溶液中含有的Na+数是0.2×6.02×1023 | |
| B. | 1molMg变成Mg2+时失去的电子数是6.02×1023 | |
| C. | 常温常压下,16gO2中含有的原子数是6.02×1023 | |
| D. | NO的摩尔质量与6.02×1023个NO分子的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
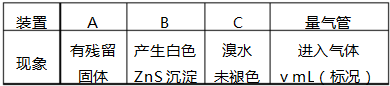

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是化肥工业和基础化工的重要原料.请回答下列问题:
氨是化肥工业和基础化工的重要原料.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
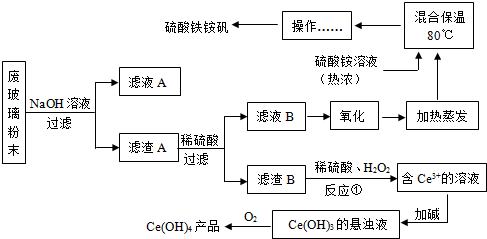

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种 | B. | 四种 | C. | 五种 | D. | 六种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com