
| A.离子化合物中可能含有非极性键 | B.分子晶体中不含离子键 |
| C.原子晶体中可能含有非极性键 | D.分子晶体中一定有共价键 |
 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源:不详 题型:填空题

 )中含有σ键的数目为_________个。
)中含有σ键的数目为_________个。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | Li | Be | B | C | N | O | F |
| 电负性 | 0.98 | 1.57 | 2.04 | 2.55 | 3.04 | 3.44 | 3.98 |
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
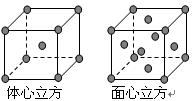
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 微粒 | a | b | c | d | e | f | g |
| 原子核数 | 双核 | 双核 | 三核 | 四核 | 四核 | 五核 | 五核 |
| 所带单位电荷 | 0 | -1 | 0 | 0 | +1 | | +1 |
 ④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。
④Ni2+可与d形成配位数为6的配离子,该配离子的化学式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属晶体和离子晶体(固态时)都能导电 |
| B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用 |
| C.金属晶体和离子晶体都可采取“紧密堆积”方式 |
| D.金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂,因而都具有延展性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.LaNi6 | B.LaNi3 |
| C.LaNi4 | D.LaNi5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ar 、N2、 Si | B.金刚石、 O2、F2 | C.Ba(OH)2、K2O 、CaCl2 | D.NH3、CO2、CH4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com