
| m |
| V |
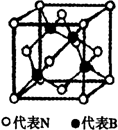 ,氮化硼每个晶胞中有4个N原子、4个B原子,晶胞的体对角线是B-N键的键长的4倍,设B-N键为x pm,则晶胞边长l=
,氮化硼每个晶胞中有4个N原子、4个B原子,晶胞的体对角线是B-N键的键长的4倍,设B-N键为x pm,则晶胞边长l=4
| |||
| 3 |
| 25 |
| NA |
4
| |||
| 3 |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
 (或
(或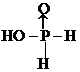 ),故答案为:
),故答案为: (或
(或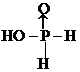 );
);

科目:高中化学 来源: 题型:
| A、若甲为钠单质,丁为氢气,则乙一定是水 |
| B、若甲为铝单质,丁为铁单质,则乙一定是氧化铁 |
| C、若甲为铜单质,丁为氯化亚铁溶液,则乙一定是氯化铁溶液 |
| D、若甲、乙、丙、丁均为化合物,则该反应一定属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +O2 |
| +O2 |
| +H2O |
| +O2 |
| +O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
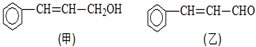

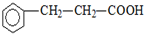 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂和乙酸乙酯都是纯净物,在室温下都是液体 |
| B、油脂和乙酸乙酯都能水解生成羧酸和醇 |
| C、油脂和乙酸乙酯都不能使溴水褪色 |
| D、油脂和乙酸乙酯都不溶于水,而易溶于有机溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com