
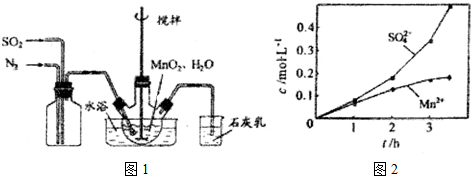
分析 (1)①根据题中所示的石灰乳的作用是吸收尾气二氧化硫来回答;
②根据实验的操作原则,为了让气体尽可能转化,要根据反应所需的条件和用量严格操作;
③考虑氮气的化学性质稳定,空气中氧气的活泼性等因素的影响;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应方程式为SO2+Ca(OH)2=CaSO3+H2O,
答案为:SO2+Ca(OH)2=CaSO3+H2O;
②为使SO2尽可能转化完全,应定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,
故答案为:控制适当的温度、缓慢通入混合气体;
③氮气的化学性质稳定,空气中氧气性质活泼,在Mn2+催化作用下,易把亚硫酸氧化成硫酸,而使硫酸根浓度增大,
故答案为:Mn2+催化氧气与亚硫酸反应生成硫酸;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,所以实验步骤为)①边搅拌边加入 Na2CO3,并控制溶液pH<7.7;②过滤,用少量水洗涤2~3次;③检验SO42-是否被洗涤干净:取最后一次洗涤液于试管中,滴加BaCl2溶液,再滴加稀盐酸,若无沉淀生成,则洗涤干净;④用少量C2H5OH洗涤;⑤低于100℃干燥,
故答案为:①Na2CO3;pH<7.7;②过滤,用少量水洗涤2~3次;③取最后一次洗涤液于试管中,滴加BaCl2溶液,再滴加稀盐酸,若无沉淀生成,则洗涤干净;⑤低于100℃干燥.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程,正确识图、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L NH4Al(SO4)2溶液与0.01mol•L-1Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 将标准状况下的11.2L氯气通入200mL2mol•L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) | |
| C. | 浓度均为0.1mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前必须检查容量瓶是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 称好的固体试样需用纸条小心地送入容量瓶中 | |
| D. | 摇匀后发现凹液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
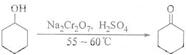
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
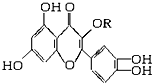 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②④⑤⑥ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com