
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是( )
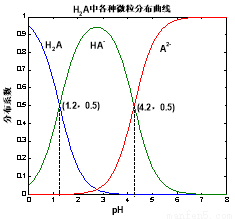
A.H2A 2H+ + A2- K=10-5.4
2H+ + A2- K=10-5.4
B.在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.已知25℃时HF的 Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为: H2A+F-═ HF+HA-
D.将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.原子核内有10个中子的氧原子
B.乙烯的结构简式为:C2H4
C.CH4分子的比例模型:
D.CO2的电子式:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
对10mL1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A.加入一定量的CaCl2 B.加入5mL1.5mol/L的盐酸
C.加入15mL0.5mol/L的盐酸 D.加入5mLH2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的还原性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市等十校高三3月联考理综化学试卷(解析版) 题型:实验题
新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
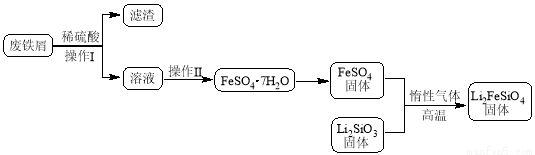
实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市等十校高三3月联考理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.从海水中提取溴、碘都涉及置换反应,从矿物质中获取铝、铁、铜、硅都不涉及置换反应
B.利用溶解度数据可推测将一些混合物质分离开来的可能性,利用原子半径数据可推测某些原子的氧化性和还原性的强弱
C.因为食盐能使细菌变性,所以可以用食盐水杀死H7N9禽流感病毒
D.某反应的ΔH>0、ΔS﹤0,则该反应一定不能正向进行
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:选择题
在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
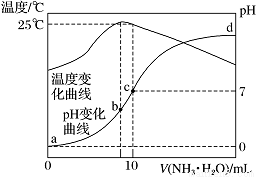
A.n=1.0
B.水的电离程度:b>c>a>d
C.c点:c(NH)=c(Cl-)=1.0 mol·L-1
D.25 ℃时,NH4Cl的水解常数(Kh)计算式为=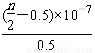
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:选择题
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(Cl-)>c(CH3COOH)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
对于可逆反应:2NO2(g) N2O4(g)正反应放热。下列判断正确的是
N2O4(g)正反应放热。下列判断正确的是
A.升高温度,混合气体颜色变浅
B.平衡时,NO2浓度必定等于N2O4浓度的两倍
C.平衡时,反应不在进行
D.平衡时,各组分浓度不再随时间的延长而发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com