
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 。 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 。 下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 反应需在300℃条件下进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是
A. 1.2mol/(L·min)
B. 1.8mol/(L·min)
C. 0.02mol/(L·min)
D. 0.18mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,E,F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( ) 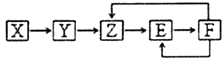
A.X可能是一种氢化物
B.X生成Z一定是化合反应
C.E可能是一种有色气体
D.F中M元素的化合价可能为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 化学反应中的能量变化主要是由化学键变化引起的
B. 铝热反应是放热反应,因此不需要加热就能使反应发生
C. 硝酸铵溶于水温度降低,这个变化是吸热反应
D. 化学反应中的能量变化的大小与反应物的质量大小无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)写出表示含有8个质子,10个中子的原子的化学符号: .
(2)根据下列微粒回答问题: ![]() H,
H, ![]() H,
H, ![]() H,14C,14N,16O,35Cl2、37Cl2 .
H,14C,14N,16O,35Cl2、37Cl2 .
①以上8种微粒共有种核素,共种元素.
②互为同位素的是 .
③质量数相等的是和 , 中子数相等的是和 .
(3)相同物质的量的14CO2与S18O2的质量之比为;中子数之比为;电子数之比为 .
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是: . (铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验SO2中是否混有CO2气体,可采用的方法是
A. 通过品红溶液,若品红溶液褪色,则说明混有CO2气体
B. 通过澄清石灰水,若变混浊,则说明混有CO2气体
C. 先通过足量NaOH溶液,再通过澄清石灰水,若变混浊,则说明混有CO2气体
D. 先通过足量KMnO4溶液,再通过澄清石灰水,若变混浊说明混有CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。
(1)以丁烯和乙烯为原料制备丙烯的方法被称为“烯烃歧化法",主要反应为C4H8(g)+C2H4(g)![]() 2C3H6(g)
2C3H6(g)
已知相关燃烧热数据:
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1411kJ·mol-1
C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) △H3=-2539kJ·mol-1
①乙烯的电子式为______________。
②相同质量的C2H4(g)、C3H6(g)和C4H8(g)充分燃烧,放出的热量由多到少的顺序依次为______________(填写化学式)。
③ 上述“烯烃歧化法”的反应的热化学方程式为___________。
(2)“丁烯裂解法”是另一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。
反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:

①平衡体系中的丙烯和乙烯的质量比[![]() ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号)
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号)
A. 300℃ 0.1MPa B. 700℃ 0.1MPa
C.300℃ 0.5MPa D.700℃ 0.5MPa
②有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是__________。
③图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com