
”¾ĢāÄæ”湤ŅµÉĻŅŌīŃĢśæó£ØÖ÷ŅŖ³É·ÖĪŖīŃĖįŃĒĢś£ØFeTiO3£©£¬ŗ¬ÓŠMgO”¢SiO2µČŌÓÖŹ£©ĪŖŌĮĻ£¬Öʱø½šŹōīŃŗĶĢśŗģµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ

ŅŃÖŖ£ŗĖįČÜŹ±£¬FeTiO3×Ŗ»ÆĪŖFe2+ŗĶTiO2+
£Ø1£©FeTiO3ÖŠTiŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ_____¼Ū£¬ĢśŗģµÄÓĆĶ¾ĪŖ____________£ØČĪŠ“Ņ»ÖÖ£©”£
£Ø2£© ”°Ė®½ā”±ÖŠ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ______________________________”£
£Ø3£© ”°³ĮĢś”±ÖŠ£¬Éś³ÉµÄĖįŠŌĘųĢ¬²śĪļµÄµē×ÓŹ½ĪŖ______________£»øĆ¹ż³ĢæŲÖĘ·“Ó¦ĪĀ¶ČµĶÓŚ35”ę£¬ŌŅņĪŖ_______________________________________”£
£Ø4£©FeCO3×Ŗ»ÆĪŖĢśŗģŹ±£¬·¢ÉśµÄ»Æѧ·½³ĢŹ½ĪŖ_______________________________”£
£Ø5£©ÖʵƵÄFeCO3æɼÓČė×ćĮæµÄĻ”ĮņĖį£¬Ōņ“ÓČÜŅŗÖŠ»ńµĆĀĢ·ÆµÄ²Ł×÷ŹĒ_____________”£
£Ø6£©µē½āÉś²śīŃŹ±ÓĆTiO2 ŗĶŹÆÄ«×öµē¼«£¬µē½āÖŹĪŖČŪČŚµÄCaO£¬ŌņŅõ¼«µÄ·“Ó¦Ź½ĪŖ_______”£
”¾“š°ø”æ+4 ×÷ŗģÉ«ÓĶĘįŗĶĶæĮĻ”¢Ņ±ĢśµČ ![]()
![]() ·ĄÖ¹Ģ¼ĖįĒāļ§·Ö½ā
·ĄÖ¹Ģ¼ĖįĒāļ§·Ö½ā 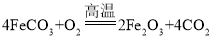 Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ£ØøÉŌļ£© TiO2+4e-=Ti+2O2-
Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ£ØøÉŌļ£© TiO2+4e-=Ti+2O2-
”¾½āĪö”æ
īŃĢśæóÓĆĮņĖįČÜŅŗČܽā£¬·¢ÉśFeTiO3+2H2SO4ØTFeSO4+TiOSO4+2H2O”¢MgO+H2SO4ØTMgSO4+H2O£¬¹żĀĖ·ÖĄė³öĀĖŌü1ĪŖSiO2£¬ĀĖŅŗÖŠŗ¬ÓŠTiOSO4”¢FeSO4¼°Ī“·“Ó¦µÄĮņĖįµČ£¬Ė®½āÉś³ÉH2TiO3£¬ģŃÉÕŗóµē½āŃõ»ÆĪļÉś³ÉTi£»ĀĖŅŗ2ŗ¬ÓŠFe2+”¢Mg2+£¬¼ÓĢ¼ĖįĒāļ§ČÜŅŗ³ĮµķŃĒĢśĄė×Ó£¬Éś³ÉĢ¼ĖįŃĒĢśģŃÉÕÉś³ÉŃõ»ÆĢś£»ĀĖŅŗ3ŗ¬Ć¾Ąė×Ó£¬ĀĖŅŗ3æÉÓĆÓŚÖʱøMg(OH)2£¬Qc£¾KspŹ±Éś³É³Įµķ£¬ŅŌ“ĖĄ“½ā“š”£
(1)FeTiO3ÖŠTiŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ0-(+2)-(-2)”Į3=+4¼Ū”£ĢśŗģµÄÓĆĶ¾ĪŖÖʱøŗģÉ«ŃÕĮĻŗĶÓĶĘį”¢Ņ±Į¶ĢśµČ£»
(2)”°Ė®½ā”±ÖŠ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ![]() £Ø»ņ
£Ø»ņ![]() £©£»
£©£»
(3)”°³ĮĢś”±ÖŠ£¬ĘųĢ¬²śĪļµÄµē×ÓŹ½ĪŖ![]() £»øĆ¹ż³ĢŠčæŲÖĘ·“Ó¦ĪĀ¶ČµĶÓŚ35”ę£¬ŌŅņĪŖ·ĄÖ¹NH4HCO3·Ö½ā(»ņ¼õÉŁFe2+µÄĖ®½ā)£»
£»øĆ¹ż³ĢŠčæŲÖĘ·“Ó¦ĪĀ¶ČµĶÓŚ35”ę£¬ŌŅņĪŖ·ĄÖ¹NH4HCO3·Ö½ā(»ņ¼õÉŁFe2+µÄĖ®½ā)£»
(4)FeCO3×Ŗ»ÆĪŖĢśŗģŹ±£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ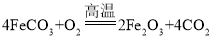 £»
£»
(5)FeCO3ČÜÓŚ×ćĮæµÄĻ”ĮņĖįµĆµ½FeSO4ČÜŅŗ£¬ŌŁ½«“ĖČÜŅŗ¾¹żÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ(øÉŌļ)µČ²Ł×÷¼“æÉ»ńµĆĀĢ·Æ¾§Ģ壻
(6)µē½āŹ±£¬Ņõ¼«·¢Éś»¹Ō·“Ӧɜ³ÉTi£¬µē¼«·½³ĢŹ½ĪŖTiO2+4e-=Ti+2O2-”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠ”×éĪŖĮĖŃŠ¾æĶā½ēĢõ¼ž¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬½ųŠŠĮĖĖįŠŌøßĆĢĖį¼ŲÓė²ŻĖįµÄ·“Ó¦£¬¼ĒĀ¼ŅŌĻĀŹµŃ鏿¾Ż£ŗ
ŹµŃ鱹ŗÅ | ŹµŃéĪĀ¶Č | ŹŌ¹ÜÖŠĖł¼ÓŹŌ¼Į¼°ĘäÓĆĮæ / mL | ČÜŅŗĶŹÖĮĪŽÉ«ĖłŠčŹ±¼ä/ min | |||
0.6mol/L H2C2O4 ČÜŅŗ | H2O | 3mol/L H2SO4 Ļ”ČÜŅŗ | 0.05mol/L KMnO4ČÜŅŗ | |||
¢Ł | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
¢Ś | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
¢Ū | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
£Ø1£©ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½__________________________________________,µ±øĆ·“Ó¦ŅŌ±ķÖŠŹż¾Ż·“Ó¦ĶźČ«Ź±×ŖŅʵē×ÓŹżĪŖ_______________NA
£Ø2£©V1 ______
£Ø3£©øł¾ŻÉĻ±ķÖŠµÄŹµŃé¢Ł”¢¢ŚŹż¾Ż£¬æÉŅŌµĆµ½µÄ½įĀŪŹĒ_____”£
£Ø4£©Ģ½¾æĪĀ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬Ó¦Ń”Ōń_____£ØĢīŹµŃ鱹ŗÅ£©
£Ø5£©øĆŠ”×éĶ¬Ń§øł¾Ż¾Ńé»ęÖĘĮĖ n £ØMn 2+ £©Ėꏱ¼ä±ä»ÆµÄĒ÷ŹĘČēĶ¼ 1 ĖłŹ¾£¬µ«ÓŠĶ¬Ń§²éŌÄŅŃÓŠµÄŹµŃé׏ĮĻ·¢ĻÖ£¬øĆŹµŃé¹ż³ĢÖŠ n £ØMn 2+ £© Ėꏱ¼ä±ä»ÆµÄŹµ¼ŹĒ÷ŹĘČēĶ¼ 2 ĖłŹ¾”£

øĆŠ”×éĶ¬Ń§øł¾ŻĶ¼ 2 ĖłŹ¾ŠÅĻ¢Ģį³öĮĖŠĀµÄ¼ŁÉč£¬²¢Éč¼ĘŅŌĻĀŹµŃé·½°ø¼ĢŠų½ųŠŠŹµŃéĢ½¾æ”£
ŹµŃ鱹ŗÅ | ŹµŃéĪĀ¶Č/”ę | ŹŌ¹ÜÖŠĖł¼ÓŹŌ¼Į¼°ĘäÓĆĮæ | ŌŁ¼ÓČėijÖÖ¹ĢĢå | ČÜŅŗĶŹÖĮĪŽÉ«ĖłŠčŹ±¼ä / min | |||
¢Ü | 25 | 0.6mol/L H2C2O4 ČÜŅŗ | H2O | 3mol/L H2SO4 Ļ”ČÜŅŗ | 0.05mol/L KMnO4 ČÜŅŗ | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
¢ŁøĆŠ”×éĶ¬Ń§Ģį³öµÄ¼ŁÉčŹĒ_____”£
¢ŚČōøĆŠ”×éĶ¬Ń§Ģį³öµÄ¼ŁÉč³ÉĮ¢£¬Ó¦¹Ū²ģµ½_________________________________ĻÖĻó”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æīė¼°Ęä»ÆŗĻĪļµÄÓ¦ÓĆÕżČÕŅę±»ÖŲŹÓ”£
£Øl£©×īÖŲŅŖµÄŗ¬īėæóĪļŹĒĀĢÖłŹÆ£¬ŗ¬2%øõ£ØCr£©µÄĀĢÖłŹÆ¼“ĪŖ×ęÄøĀĢ”£»łĢ¬CrŌ×Ó¼Ūµē×ӵĹģµĄ±ķŹ¾Ź½ĪŖ______________________________”£
£Ø2£©īėÓėĻąĮŚÖ÷×åµÄĀĮŌŖĖŲŠŌÖŹĻąĖĘ”£ĻĀĮŠÓŠ¹ŲīėŗĶĀĮµÄŠšŹöÕżČ·µÄÓŠ_____£ØĢī±źŗÅ£©”£
A£®¶¼ŹōÓŚpĒųÖ÷×åŌŖĖŲ B£®µēøŗŠŌ¶¼±ČĆ¾“ó
C£®µŚŅ»µēĄėÄܶ¼±ČĆ¾“ó D£®¶¼ÄÜÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦
£Ø3£©īė”¢Ć¾¾§Ģ嶼ŹĒÓɽšŹōŌ×ÓĆÜÖĆ²ćŌŚČżĪ¬æÕ¼ä¶Ń»ż¶ų³É£Ø×īĆܶѻż£©”£īėµÄČŪµć±ČĆ¾µÄČŪµćøߣ¬ŌŅņŹĒ_____________________________________________________”£
£Ø4£©ĀČ»ÆīėŌŚĘųĢ¬Ź±“ęŌŚBeC12·Ö×Ó£Øa£©ŗĶ¶ž¾Ū·Ö×Ó£ØBeCl2£©2£Øb£©£¬¹ĢĢ¬Ź±Ōņ¾ßÓŠČēĶ¼ĖłŹ¾µÄĮ“ד½į¹¹£Øc£©”£

¢ŁaŹōÓŚ_____”°¼«ŠŌ”±»ņ”°·Ē¼«ŠŌ”±£©·Ö×Ó”£
¢ŚbÖŠBeŌ×ÓµÄŌӻƷ½Ź½ĻąĶ¬£¬ĒŅĖłÓŠŌ×Ó¶¼ŌŚĶ¬Ņ»Ę½ĆęÉĻ”£b µÄ½į¹¹Ź½ĪŖ________£Ø±ź³öÅäĪ»¼ü£©”£
¢ŪcÖŠBeŌ×ÓµÄŌӻƷ½Ź½ĪŖ_____”£
¢ÜĀČ»Æīė¾§ĢåÖŠ“ęŌŚµÄ×÷ÓĆĮ¦ÓŠ_____£ØĢī±źŗÅ£©”£
A£®·¶µĀ»ŖĮ¦ B£®¦Ņ¼ü C£®¼«ŠŌ¼ü D£®·Ē¼«ŠŌ¼ü E£®Ąė×Ó¼ü
£Ø5£©BeOĮ¢·½¾§°ūČēĶ¼ĖłŹ¾”£

¢ŁBeO¾§ĢåÖŠ£¬O2©µÄÅäĪ»ŹżĪŖ_____”£
¢ŚČōBeO¾§ĢåµÄĆܶČĪŖdg/cm3£¬BeOµÄĦ¶ūÖŹĮæĪŖMg”¤mol-1£¬°¢·üŁ¤µĀĀŽ³£ŹżĪŖNA£¬Ōņ¾§°ū²ĪŹża=_______________ cm £ØĮŠ³ö¼ĘĖćŹ½¼“æÉ£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©¢ŁŌŚBF3·Ö×ÓÖŠ£¬F”ŖB”ŖFµÄ¼ü½ĒŹĒ________£¬BŌ×ÓµÄŌӻƹģµĄĄąŠĶĪŖ________£¬BF3ŗĶ¹żĮæNaF×÷ÓĆæÉÉś³ÉNaBF4£¬BF![]() µÄĮ¢Ģå¹¹ŠĶĪŖ________£»
µÄĮ¢Ģå¹¹ŠĶĪŖ________£»
¢ŚŌŚÓėŹÆÄ«½į¹¹ĻąĖʵÄĮł·½µŖ»ÆÅš¾§ĢåÖŠ£¬²ćÄŚBŌ×ÓÓėNŌ×ÓÖ®¼äµÄ»Æѧ¼üĪŖ________£¬²ć¼ä×÷ÓĆĮ¦ĪŖ________”£
£Ø2£©¢ŁY2X2(C2H2)·Ö×ÓÖŠYŌ×Ó¹ģµĄµÄŌÓ»ÆĄąŠĶĪŖ______£¬1 mol Y2X2ŗ¬ÓŠ¦Ņ¼üµÄŹżÄæĪŖ______”£
¢ŚŌŖĖŲY(C)µÄŅ»ÖÖŃõ»ÆĪļÓėŌŖĖŲZ(N)µÄŅ»ÖÖŃõ»ÆĪļ»„ĪŖµČµē×ÓĢ壬ŌŖĖŲZµÄÕāÖÖŃõ»ÆĪļµÄ·Ö×ÓŹ½ĪŖ________”£
¢Ū»ÆŗĻĪļZX3(NH3)µÄ·Šµć±Č»ÆŗĻĪļYX4(CH4)µÄøߣ¬ĘäÖ÷ŅŖŌŅņŹĒ______________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆĄ¹śµÄµ¤Äį¶ū”¤ÅµĒŠĄ²©Źæ¹«²¼ĮĖ×Ō¼ŗĶŶÓŃŠ·¢µÄ”°ČĖŌģŹ÷Ņ¶”±£¬ĖüæÉŅŌÓėČ¼ĮĻµē³Ų¹²Ķ¬¹¹³ÉŅ»øöŠĀµÄ·¢µē×°ÖĆ”Ŗ”ŖĢ«ŃōÄÜČ¼ĮĻµē³Ų,¹¤×÷ŌĄķČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ


A.Ģ«ŃōÄÜČ¼ĮĻµē³ŲµÄÓŵćĪŖĪŽĀŪĢģĘųČēŗĪ,¾łÄܳ֊ų¹©Ó¦µēÄÜ,²¢ĒŅŹµĻÖ¶Ō»·¾³µÄ”°ĮćÅÅ·Å”±
B.Ķ¼AÖŠĖÜĮĻ±”ĤÉĻ²æµÄ·“Ó¦ĪŖ2H++2e-![]() H2”ü
H2ӟ
C.Ķ¼BČ¼ĮĻµē³Ų¹¤×÷Ź±µÄøŗ¼«·“Ó¦ĪļĪŖO2
D.”°ČĖŌģŹ÷Ņ¶”±ÉĻ·¢ÉśµÄ·“Ó¦ĪŖ6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ŌĶæóÓėĶĄ¶æó¶¼ŹĒĢģČ»ŗ¬ĮņĶæó£¬ŌŚµŲæĒÖŠ¶žÕß³£°éÉś“ęŌŚ”£ĻÖČ”Ņ»·ŻøĆ°éÉśæóѳʷ£¬¾¼ģ²āŗóČ·¶Ø½öŗ¬Cu2S”¢CuSŗĶ¶čŠŌŌÓÖŹ”£ĪŖ½ųŅ»²½Č·¶ØĘäÖŠCu2S”¢CuSµÄŗ¬Į棬ijĶ¬Ń§½ųŠŠĮĖČēĻĀŹµŃé£ŗ
¢ŁČ”2.6gѳʷ£¬¼ÓČė200.0mL0.2000mol”¤L£1ĖįŠŌKMnO4ČÜŅŗ£¬¼ÓČČ(ĮņŌŖĖŲČ«²æ×Ŗ»ÆĪŖSO42£)£¬ĀĖČ„²»ČÜŌÓÖŹ£»
¢ŚŹÕ¼ÆĀĖŅŗÖĮ250mLČŻĮæĘæÖŠ£¬¶ØČŻ£»
¢ŪČ”25.00mLČÜŅŗ£¬ÓĆ0.1000mol”¤L£1FeSO4ČÜŅŗµĪ¶Ø£¬ĻūŗÄ20.00mL£»
¢Ü¼ÓČėŹŹĮæNH4HF2ČÜŅŗ(ŃŚ±ĪFe3+ŗĶMn2+£¬Ź¹Ęä²»ŌŁ²ĪÓėĘäĖū·“Ó¦)£¬ŌŁ¼ÓČė¹żĮæKI¹ĢĢ壬ĒįŅ”Ź¹Ö®Čܽā²¢·¢Éś·“Ó¦£ŗ2Cu2++4I£=2CuI+I2£»
¢Ż¼ÓČė2µĪµķ·ŪČÜŅŗ£¬ÓĆ0.1000mo1”¤L£1Na2S2O3ČÜŅŗµĪ¶Ø£¬ĻūŗÄ30.00mL(ŅŃÖŖ£ŗ2S2O32£+I2=S4O62£+2I£)”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Š“³öCu2SČÜÓŚĖįŠŌKMnO4ČÜŅŗµÄĄė×Ó·½³ĢŹ½£ŗ___________£»
(2)ÅäÖĘ0.1000mol”¤ L£1FeSO4ČÜŅŗŹ±ŅŖÓĆÖ󷊹żµÄĻ”ĮņĖį£¬ŌŅņŹĒ___________£¬ÅäÖĘ¹ż³ĢÖŠĖłŠč²£Į§ŅĒĘ÷³żĮĖÉÕ±”¢²£Į§°ō”¢ČŻĮæĘæĶā»¹ÓŠ___________£»
(3)¢ŪÖŠČ”25.00mL“ż²āČÜŅŗĖłÓƵÄŅĒĘ÷ŹĒ___________£»
(4)¢ŻÖŠµĪ¶ØÖĮÖÕµćŹ±µÄĻÖĻóĪŖ___________£»
(5)»ģŗĻѳʷ֊Cu2SŗĶCuSµÄŗ¬Įæ·Ö±šĪŖ_________%”¢_________%(½į¹ū¾ł±£Įō1Ī»Š”Źż)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄNaOHČÜŅŗŹ±£¬NaOH¹ĢĢåČܽāŗóĪ“»Öø“µ½ŹŅĪĀ¾Ķ×ŖŅĘ”¢¶ØČŻ£¬ĖłÅäÖʵÄČÜŅŗÅضČĘ«“ó
B. ÓĆ¹ć·ŗpHŹŌÖ½²āµĆĀČĖ®µÄpHĪŖ3
C. ÓĆĶŠÅĢĢģĘ½³ĘČ”5.86gŹ³ŃĪ
D. ÓĆĻøĢśĖæ·ÅŌŚ¾Ę¾«µĘ»šŃęÉĻ×ĘÉÕÖĮĪŽÉ«£¬Č»ŗóÕŗȔɣĮæ“ż²āŅŗ£¬Ķø¹żĄ¶É«īܲ£Į§¹Ū²ģ»šŃę³Ź×ĻÉ«£¬ĖµĆ÷“ż²āŅŗÖŠŅ»¶Øŗ¬ÓŠK+£¬Ć»ÓŠNa+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦£ŗX(g)+2Y(g)![]() 3Z(g) ”÷H=-akJ”¤mol-1£Øa>0£©”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
3Z(g) ”÷H=-akJ”¤mol-1£Øa>0£©”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. “ļµ½Ę½ŗāדĢ¬Ź±£¬·Å³öµÄČČĮæŅ»¶ØŠ”ÓŚa kJ
B. ĻņĢåĻµÖŠ¼ÓČėX£Øg£©Ź±£¬Õż”¢Äę·“Ó¦ĖŁĀŹŅ»¶Ø¶¼Ōö“ó
C. µ±ČŻĘ÷ÄŚµÄŃ¹Ēæ±£³Ö²»±äŹ±£¬Ōņ·“Ó¦Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬
D. ČōYÓėZµÄĪļÖŹµÄĮæÖ®±Č±£³Ö²»±ä£¬Ōņ·“Ó¦“ļµ½Ę½ŗāדĢ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓÉC”¢H”¢OČżÖÖŌŖĖŲ×é³ÉµÄĮ“דӊ»ś»ÆŗĻĪļX£¬Ö»ŗ¬ÓŠōĒ»łŗĶōČ»łĮ½ÖÖ¹ŁÄÜĶÅ£¬ĒŅōĒ»łŹżÄæ“óÓŚōČ»łŹżÄ攣³ĘČ”2.04 g“æ¾»µÄX£¬Óė×ćĮ潚ŹōÄĘ³ä·Ö·“Ó¦£¬Éś³É672 mLĒāĘų(±ź×¼×“æö)”£ĒėČ·¶ØĦ¶ūÖŹĮæ×īŠ”µÄX·Ö×ÓÖŠōĒ»ł”¢ōČ»łŹżÄæ¼°øĆXµÄĻą¶Ō·Ö×ÓÖŹĮæ(ŅŖĒ󊓳ö¼ņŅŖĶĘĄķ¹ż³Ģ)”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com