
【题目】下列指定反应的离子方程式正确的是
A. 澄清石灰水中通入过量二氧化碳:OH-+CO2=HCO3-
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClO- = SO42-+Cl-+2H+
D. 下图所示装置中反应:Zn+Cu2+= Cu + Zn2+

【答案】A
【解析】
A. 澄清石灰水中通入过量二氧化碳生成碳酸氢钙;
B. 离子反应需注意电荷守恒;
C. 次氯酸为弱酸,在离子方程式中不能拆写;
D.未形成闭合回路,不会发生原电池反应。
A.澄清石灰水中通入二氧化碳先生成碳酸钙沉淀后,过量后沉淀溶解为碳酸氢钙溶液,碳酸氢钙要拆写为钙离子与碳酸氢根离子,故反应前后变化为:OH-+CO2=HCO3-,A正确;
B.反应式中电荷不守恒,未配平,应为5I +IO3+6H+![]() 3I2+3H2O,B不正确;
3I2+3H2O,B不正确;
C.漂白粉溶液吸收少量二氧化硫气体,而漂白粉过量,溶液中还有大量ClO,则不会有大量的H+生成,应生成次氯酸分子:SO2+H2O+3ClO- =SO42-+Cl-+2HClO,C不正确;
D.图示装置未形成闭合回路,并未形成原电池,故写成原电池反应Zn+Cu2+= Cu+Zn2+,D不正确。故选A。


科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。

据图判断正确的是
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点酸的总浓度大于a点酸的总浓度
C.a点Kw的数值比c点Kw的数值大
D.b点溶液的导电性比c点溶液的导电性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该物质的叙述错误的是( )

A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:
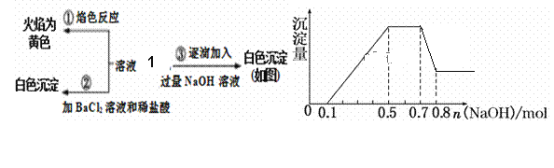
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是___________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______,所得沉淀的最大质量是______g。
(4)若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?____(填“存在”“不存在”或“不确定”)。若存在, c(NO3-) = _____ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径:
元素 | N | S | O | Si |
原子半径/1010 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷元素的原子半径可能是
A. 0.80×1010 m B. 1.10×1010 m
C. 1.20×1010 m D. 0.70×1010 m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(分子式为N2H4,又称联氨)具有可燃性,在氧气中完全燃烧生成氮气,可用作燃料电池的燃料。由题图信息可知下列叙述不正确的是( )

甲 乙
A. 甲为原电池,乙为电解池
B. b电极的电极反应式为O2+4e-=2O2-
C. d电极的电极反应式为Cu2++2e-=Cu
D. c电极质量变化128 g时,理论消耗标准状况下的空气约为112 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验方案所得到的现象,得出的结论一定正确的是
甲中玻璃管盛放的物质 | 乙中现象 | 结论 | |
A | 还原铁粉、用水湿润的玻璃纤维 | 肥皂水中有气泡 | 水蒸气高温下与铁反应生成了氢气 |
B | CaCO3 、SiO2 | 石灰水变浑浊 | CaCO3 和 SiO2 高温下反应生成了 CO2 |
C | 碎瓷片、石蜡油(主要成分为烷烃) | 酸性 KMnO4 溶液褪色 | 石蜡油可能发生了分解反应 |
D | FeCl3 固体(熔点 306℃、沸点 315℃)、MnO2 固体 | 淀粉 KI 溶液变蓝 | 加热时 MnO2 能将 FeCl3 氧化成 Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。完成下列填空:
(1)碳原子的原子结构示意图是_____________;CO2中所含共价键的类型_____________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。_______________。
(3)SO2 与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________________,证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+ H2O→Na2SO4+H2SO4,该反应中,氧化产物是______;若反应中转移了0.04mol的电子,有________g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。
为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL 该溶液于锥形瓶中,用0.1000mol/L的KMnO4 溶液滴定。重复上述操作2 次,平均消耗KMnO4 溶液21.00mL。则该样品中Na2S2O4的质量分数为__________(杂质不参与反应)。(保留至0.1%)
(6)“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。请写出金属钒与浓硝酸反应的离子方程式:_______________________________________。
(7)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:__________、_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com