
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是___________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
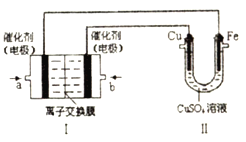
如图,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式是___________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为___________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=___________(假设电解后溶液体积不变)。
【答案】 Cu2++2H2O![]() Cu(OH)2+2H+ CH4-8e-+10OH-=CO32-+7H2O 2CuSO4+2H2O
Cu(OH)2+2H+ CH4-8e-+10OH-=CO32-+7H2O 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 1
2Cu+O2↑+2H2SO4 1
【解析】(1)硫酸中氢离子抑制铜离子水解。
(2) 实现铁上镀铜,Cu为阳极,则b为正极,a为负极,甲烷失去电子,在碱性环境下生成碳酸根离子。把Ⅱ中电极均换为惰性电极,电极硫酸铜生成Cu、氧气、硫酸;根据电解方程式:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 ;2NaCl+2H2O
2Cu+O2↑+2H2SO4 ;2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;阳极生成的气体为氧气、氯气,结合离子的放电顺序可以知道,先生成氯气,结合电子守恒来计算。
2NaOH+H2↑+Cl2↑;阳极生成的气体为氧气、氯气,结合离子的放电顺序可以知道,先生成氯气,结合电子守恒来计算。
(1) CuSO4属于强酸弱碱盐,发生Cu2++2H2O![]() Cu(OH)2+2H+反应,水解显酸性,加入一定量的硫酸溶液,氢离子抑制铜离子的水解;正确答案:Cu2++2H2O
Cu(OH)2+2H+反应,水解显酸性,加入一定量的硫酸溶液,氢离子抑制铜离子的水解;正确答案:Cu2++2H2O![]() Cu(OH)2+2H+ 。
Cu(OH)2+2H+ 。
(2) 实现铁上镀铜,Cu为阳极,则b为正极,通入的气体氧气,a为负极,甲烷失去电子,电极反应为CH4-8e-+10OH-=CO32-+7H2O;把Ⅱ中电极均换为惰性电极,电解硫酸铜,阴极生成Cu、阳极生成氧气、硫酸,电解反应为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 ;电解混合溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,0.04mol氯离子只能生成0.02氯气,即448 mL氯气,转移0.04mol 电子,共生成672mL 气体,说明还有224 mL 气体来自于水的电解,根据4OH--4e-=O2↑+2H2O知,生成224 mL 氧气又转移0.04mol电子,所电解过程中一共转移0.08mol电子,阴极上先铜离子放电,电极反应式为Cu2++2e-= Cu,现有0.04mol铜离子恰好完全电解析出,由此可得整个过程中消耗了0.04mol 氢氧根离子,根据水的电离方程式知,溶液中氢离子浓度为0.04 mol ,则氢离子浓度为0.1mol/L,则溶液的pH=1;正确答案: CH4-8e-+10OH-=CO32-+7H2O;2CuSO4+2H2O
2Cu+O2↑+2H2SO4 ;电解混合溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,0.04mol氯离子只能生成0.02氯气,即448 mL氯气,转移0.04mol 电子,共生成672mL 气体,说明还有224 mL 气体来自于水的电解,根据4OH--4e-=O2↑+2H2O知,生成224 mL 氧气又转移0.04mol电子,所电解过程中一共转移0.08mol电子,阴极上先铜离子放电,电极反应式为Cu2++2e-= Cu,现有0.04mol铜离子恰好完全电解析出,由此可得整个过程中消耗了0.04mol 氢氧根离子,根据水的电离方程式知,溶液中氢离子浓度为0.04 mol ,则氢离子浓度为0.1mol/L,则溶液的pH=1;正确答案: CH4-8e-+10OH-=CO32-+7H2O;2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 ;1。
2Cu+O2↑+2H2SO4 ;1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关气体摩尔体积的说法,正确的是( )
A.64gSO2的体积约为22.4L
B.1molO2的体积约为22.4L,则一定处于标准状况
C.在标准状况下,1molH2O的体积约为22.4L
D.总质量为28g的N2和CO的混合气体,在标准状况下的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 常温时,在c(H+)=![]() 的溶液:Na+、Al3+、Cl-、S2-
的溶液:Na+、Al3+、Cl-、S2-
B. 由水电离的c(H+)=10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(OH-)/c(H+)=10-12的溶液中:NH4+、Al3+、NO3-、Cl-
D. 加入金属铝能放出大量H2的溶液:NH4+、K+、HCO3-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
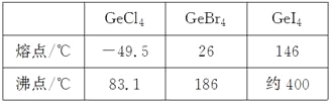
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )
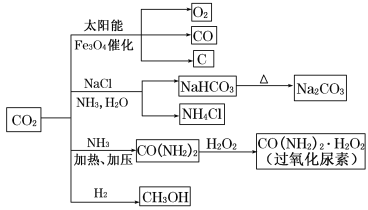
A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A. 原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B. V1:V2=1:5
C. M点时生成的CO2为0.05mol
D. a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有______,看到的现象是_______,反应的化学方程式为__________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是________,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是
2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是
A. 该反应的平衡常数不变 B. 平衡向正反应方向移动
C. SO3的浓度增大 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com