
 Na2O2(2分)
Na2O2(2分)
|
 Na2O2。
Na2O2。 ,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故②>③;
,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故②>③;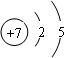 ,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂。
,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂。
|


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
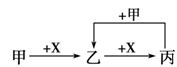
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
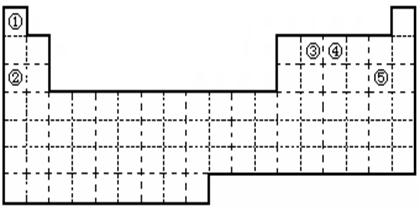
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子核都是由质子和中子构成的 |
| B.不同元素原子的质量数一定不等 |
| C.质子数决定元素种类,质子数和中子数决定原子种类 |
| D.质子数相同的粒子,其核外电子数一定相同,但化学性质不一定相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子化合物中一定含有离子键 | B.单质分子均不存在化学键 |
| C.共价化合物一定只含有极性键 | D.含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.34He | B.23He | C.24He | D.33He |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com