
| A. | 体积减半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 体积减半,压强增大,且大于原来的2倍 |
分析 体积减小一半,压强增大一倍,但平衡向气体体积减少的方向移动,最后达到平衡,但体积减半,二氧化氮浓度比原来的浓度增大,以此来解答.
解答 解:将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩气体体积,压强增大平衡正向移动;
A、若体积减小一半,压强增大,平衡正向移动,小于原来的两倍,故A错误;
B、体积减小,NO2浓度增加,混合气体颜色变深,虽然平衡向右移动,但以体积改变为主,二氧化氮浓度增大,则混合气体颜色会变深,故B错误;
C、若体积减小一半,压强瞬间增大为原来的二倍,压强增大,平衡正向移动,气体的总物质的量减小,压强有逐渐减小,所以压强小于原来的两倍,故C正确;
D、若体积减小一半,压强瞬间增大为原来的二倍,压强增大,平衡正向移动,气体的总物质的量减小,压强有逐渐减小,所以压强小于原来的两倍,故D错误;
故选C.
点评 本题考查了化学平衡的影响因素和应用,主要是恒压容器中化学平衡的变化,掌握分析方法和平衡移动原理是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
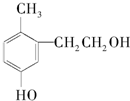
| A. | 该物质在加热条件下可以与铜反应生成一种具有醛基的化合物 | |
| B. | 1 mol该物质能与溴水反应消耗3 mol Br2发生取代反应 | |
| C. | 1 mol该有机物能与足量金属钠反应生成0.5 mol H2 | |
| D. | 1 mol该有机物能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷在通常状况下是固体 | B. | 可以有-3、+3、+5等多种化合价 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 砷的还原性比磷弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属(相同粉末状) 和物质的量(mol) | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Fe | 0.1 | 3mol/L HCl | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Cu | 0.1 | 4mol/L H2SO4 | 10 | 20℃ |
| D | Mg | 0.1 | 稀6mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO中含有NO2,用水洗涤后再干燥 | |
| B. | CO2中含有SO2,通入饱和NaHCO3溶液后干燥 | |
| C. | NH3中含有H2O,用CaCl2进行干燥 | |
| D. | SO2中含有HCl,通入饱和NaHSO3溶液后干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com