
ЁОЬтФПЁПвбжЊЃКЪЕбщЪвгУЩйСПЕФфхКЭзуСПЕФввДМЁЂХЈСђЫсжЦБИ1ЃЌ2ЉЖўфхввЭщЕФзАжУШчЭМЫљЪОЃЌЦфжаПЩФмДцдкЕФжївЊИБЗДгІгаЃКввДМдкХЈСђЫсЕФДцдкЯТдкl40ЁцЭбЫЎЩњГЩввУбЁЃгаЙиЪ§ОнСаБэШчЯТЃК
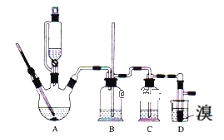
ввДМ | 1ЃЌ2ЉЖўфхввЭщ | ввУб | |
зДЬЌ | ЮоЩЋвКЬх | ЮоЩЋвКЬх | ЮоЩЋвКЬх |
УмЖШ/gcmЉ3 | 0.79 | 2.2 | 0.71 |
ЗаЕу/Ёц | 78.5 | 132 | 34.6 |
ШлЕу/Ёц | -130 | 9 | -116 |
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгУЩйСПЕФфхКЭзуСПЕФввДМЁЂХЈСђЫсжЦБИ1ЃЌ2ЉЖўфхввЭщЕФашЗжСНВННјааЃЌЕквЛВНашвЊдкБљЫЎдЁЯТЛьКЯХЈСђЫсКЭввДМЃЌЛьКЯЪБМгШыЪдМСЕФЫГађЪЧ___ЃЌЪЙгУБљЫЎдЁНЕЮТЕФФПЕФЪЧ___ЃЌЕкЖўВНЗДгІЕФЛЏбЇЗНГЬЪН___ЁЃ
ЃЈ2ЃЉдкДЫЪЕбщжаЃЌвЊдкAжаМгШы___ЃЌЗРжЙ___ЃЌЗДгІЮТЖШЬсИпЕН170ЁцзѓгвЃЌЦфзюжївЊФПЕФЪЧ___ЃЈЬюе§ШЗбЁЯюЧАЕФзжФИЃЉЁЃ
aЃЎв§ЗЂЗДгІ bЃЎМгПьЗДгІЫйЖШ cЃЎЗРжЙввДМЛгЗЂ dЃЎМѕЩйИБВњЮяввУбЩњГЩ
ЃЈ3ЃЉзАжУBЕФзїгУЪЧ___ЃЌдкзАжУCжагІМгШы__ЃЌЦфФПЕФЪЧЮќЪеЗДгІжаПЩФмЩњГЩЕФЫсадЦјЬхЃЈЬюе§ШЗбЁЯюЧАЕФзжФИЃЉЁЃ
aЃЎЫЎ bЃЎХЈСђЫс cЃЎЧтбѕЛЏФЦШмвК dЃЎБЅКЭЬМЫсЧтФЦШмвК
ЃЈ4ЃЉХаЖЯDжаЗДгІНсЪјЕФЗНЗЈЪЧ___ЃЌНЋDжа1ЃЌ2ЉЖўфхввЭщДжВњЦЗжУгкЗжвКТЉЖЗжаМгЫЎЃЌеёЕДКѓОВжУЃЌВњЮягІдк___ВуЃЈЬюЁАЩЯЁБЁЂЁАЯТЁБЃЉЁЃ
ЃЈ5ЃЉШєВњЮяжагаЩйСПИБВњЮяввУбЃЌПЩгУ___ЕФЗНЗЈГ§ШЅЁЃ
ЃЈ6ЃЉЗДгІЙ§ГЬжагІгУРфЫЎРфШДзАжУDЃЌЦфжївЊФПЕФЪЧввЯЉгыфхЗДгІЪБЗХШШЃЌРфШДПЩБмУтфхЕФДѓСПЛгЗЂЃЛЕЋгжВЛФмЙ§ЖШРфШДЃЈШчгУБљЫЎЃЉЃЌЦфдвђЪЧ__ЁЃ
ЁОД№АИЁПЯШввДМдйХЈСђЫс ЗРжЙввДМЛгЗЂ CH2=CH2+Br2ЁњCH2BrCH2Br ЗаЪЏ ЗРБЉЗа d ЦНКтЦјбЙЃЌЗХЖТШћ c фхЭъШЋЭЪЩЋ ЯТ еєСѓ Й§ЖШРфШДЛсЪЙЦфФ§ЙЬЖјЪЙЦјТЗЃЈЛђЕМЙмЃЉЖТШћ
ЁОНтЮіЁП
зАжУAЪЧввДМдкХЈСђЫсЕФДцдкЯТдк170ЁцЭбЫЎЩњГЩввЯЉЃЌХЈСђЫсЕФЧПбѕЛЏадЁЂЭбЫЎадЕМжТЪаГЁЕФввЯЉЦјЬхжаКЌгадгжЪЖўбѕЛЏСђЁЂЖўбѕЛЏЬМЁЂЫЎеєЦјЕШдгжЪЃЌЭЈЙ§зАжУBжаГЄЕМЙмФквКУцЩЯЩ§ЛђЯТНЕЕїНкзАжУФкбЙЧПЃЌBЮЊАВШЋЦПЃЌПЩвдЗРжЙЕЙЮќЃЌИљОнEжаФкЭтвКУцИпЕЭБфЛЏЃЌПЩвдХаЖЯЪЧЗёЗЂЩњЖТШћЃЌЖўбѕЛЏЬМЁЂЖўбѕЛЏСђФмКЭЧтбѕЛЏФЦШмвКЗДгІЃЌзАжУCЪЧРћгУЧтбѕЛЏФЦШмвКЮќЪедгжЪЦјЬхЃЌфхдкГЃЮТЯТЃЌвзЛгЗЂЃЌввЯЉгыфхЗДгІЪБЗХШШЃЌфхИќвзЛгЗЂЃЌзАжУDРфШДПЩБмУтфхЕФДѓСПЛгЗЂЃЌЕЋ1ЃЌ2-ЖўфхввЭщЕФФ§ЙЬЕу9ЁцНЯЕЭЃЌВЛФмЙ§ЖШРфШДЃЌЗёдђЛсЪЙВњЦЗФ§ЙЬЖјЖТШћЕМЙмЃЌ1ЃЌ2-ЖўфхввЭщКЭЫЎВЛЛЅШмЃЌ1ЃЌ2-ЖўфхввЭщУмЖШБШЫЎДѓЃЌЫљвдМгЫЎЃЌеёЕДКѓОВжУЃЌВњЮягІдкЯТВуЃЌЗжРыЕУЕНВњЦЗЃЌвдДЫНтД№ИУЬтЁЃ
(1)ХЈСђЫсЕФУмЖШБШввДМДѓЃЌЧвШмНтЪБЗХШШЃЌдђХфжЦЛьКЯвКЪБЯШввДМдйХЈСђЫсЃЛгУЩйСПЕФфхКЭзуСПЕФввДМЁЂХЈСђЫсжЦБИ1ЃЌ2-ЖўфхввЭщЕФашЗжСНВННјааЃЌЗДгІдРэШчЯТЃКЕквЛВНЗДгІЮЊCH3CH2OH![]() CH2 = CH2Ёќ+ H2OЃЌЕкЖўВНЗДгІЮЊCH2=CH2+Br2ЁњBrCH2CH2BrЃЛ
CH2 = CH2Ёќ+ H2OЃЌЕкЖўВНЗДгІЮЊCH2=CH2+Br2ЁњBrCH2CH2BrЃЛ
(2)вКЬхЛьКЯвКМгШШЪБашвЊМгШыЫщДЩЦЌЛђЗаЪЏЃЌвдЗРжЙБЉЗаЃЛввДМдкХЈСђЫс140ЁцЕФЬѕМўЯТЃЌЗЂЩњЗжзгФкЭбЫЎЩњГЩввУбЃЌПЩФмбИЫйЕиАбЗДгІЮТЖШЬсИпЕН170ЁцзѓгвЃЌЦфзюжївЊФПЕФЪЧЃКМѕЩйИБВњЮяввУбЩњГЩЃЌЙЪД№АИЮЊЃКdЃЛ
(3)ЪЙгУзАжУBПЩЦНКтЦјбЙЃЌЗРжЙзАжУCЛђDжаЕМЙмЖТШћЃЛХЈСђЫсОпгаЧПбѕЛЏадЃЌНЋввДМбѕЛЏГЩЖўбѕЛЏЬМЃЌздЩэБЛЛЙдГЩЖўбѕЛЏСђЃЌЖўбѕЛЏЬМЁЂЖўбѕЛЏСђФмКЭЧтбѕЛЏФЦШмвКЗДгІЖјБЛЮќЪеЃЌЗРЮлШОЛЗОГЃЌЙЪД№АИЮЊЃКcЃЛ
(4)ввЯЉФмЪЙDжавКфхЭЪЩЋЃЌдђDжафхЭъШЋЭЪЩЋЪБМДПЩЫЕУїЗДгІНсЪјЃЛНЋDжа1ЃЌ2ЉЖўфхввЭщДжВњЦЗжУгкЗжвКТЉЖЗжаМгЫЎЃЌеёЕДКѓОВжУЃЌвђ1ЃЌ2-ЖўфхввЭщКЭЫЎВЛЛЅШмЃЌЧв1ЃЌ2-ЖўфхввЭщУмЖШБШЫЎДѓЃЌдђВњЮягІдкЯТВуЃЛ
(5)1ЃЌ2-ЖўфхввЭщгыввУбЕФЗаЕуВЛЭЌЃЌСНепОљЮЊгаЛњЮяЃЌЛЅШмЃЌгУеєСѓЕФЗНЗЈНЋЫќУЧЗжРыЃЛ
(6)фхдкГЃЮТЯТЃЌвзЛгЗЂЃЌввЯЉгыфхЗДгІЪБЗХШШЃЌфхИќвзЛгЗЂЃЌРфШДПЩБмУтфхЕФДѓСПЛгЗЂЃЌЕЋ1ЃЌ2-ЖўфхввЭщЕФФ§ЙЬЕу9ЁцНЯЕЭЃЌВЛФмЙ§ЖШРфШДЃЌЙ§ЖШРфШДЛсЪЙЦфФ§ЙЬЖјЪЙЦјТЗЖТШћЃЌBжаГЄЕМЙмФквКУцЩЯЩ§ЁЃ


 гЂВХЕуНђЯЕСаД№АИ
гЂВХЕуНђЯЕСаД№АИ КьЙћзгШ§МЖВтЪдОэЯЕСаД№АИ
КьЙћзгШ§МЖВтЪдОэЯЕСаД№АИ ПЮЬУСЗМгВтЯЕСаД№АИ
ПЮЬУСЗМгВтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЗЂЩњЯТСаЗДгІЃЌЦфжаЪєгкбЮРрЫЎНтЗДгІЕФЪЧЃЈ ЃЉ
A.CH3COOЁЊЃЋH2O![]() CH3COOHЃЋOHЁЊ
CH3COOHЃЋOHЁЊ
B.Cl2ЃЋH2O ![]() HЃЋЃЋClЃЃЋHClO
HЃЋЃЋClЃЃЋHClO
C.CH3COOHЃЋNaOH![]() CH3COONaЃЋH2O
CH3COONaЃЋH2O
D.HCO3ЁЊЃЋH2O![]() H3O+ЃЋCO32-
H3O+ЃЋCO32-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2019ФъХЕБДЖћЛЏбЇНБЪкгшУРЙњЙЬЬхЮяРэбЇМвдМКВЁЄАЭФсЫЙЬиЁЄЙХЕЯФЩЃЈJohnB.GoodenoughЃЉЁЂгЂЙњЛЏбЇМвЫЙЬЙРћЁЄЭўЭЂККЃЈStanleyWhittinghamЃЉКЭШеБОЛЏбЇМвМЊвАеУЃЈAkiraYoshinoЃЉЃЌвдБэеУЫћУЧЗЂУїяЎРызгЕчГиЗНУцзіГіЕФЙБЯзЁЃШЋЙЬЬЌяЎСђЕчГиФмСПУмЖШИпЁЂГЩБОЕЭЃЌЦфЙЄзїдРэШчЭМЫљЪОЃЌЦфжаЕчМЋaГЃгУВєгаЪЏФЋЯЉЕФS8ВФСЯЃЌЕчГиЗДгІЮЊЃК16Li+xS8=8Li2SxЃЈ2ЁмxЁм8ЃЉЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
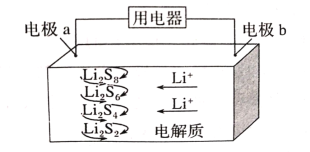
A.ЕчГиЙЄзїЪБЃЌе§МЋПЩЗЂЩњЗДгІЃК2Li2S6+2Li++2e-=3Li2S4
B.ЕчГиЙЄзїЪБЃЌЭтЕчТЗжаСїЙ§0.02molЕчзгЃЌИКМЋВФСЯМѕжи0.14g
C.ЪЏФЋЯЉЕФзїгУжївЊЪЧЬсИпЕчМЋaЕФЕМЕчад
D.ЕчГиГфЕчЪБМфдНГЄЃЌЕчГижаLi2S2ЕФСПдНЖр
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШЛЏбЧЭЪЧвЛжжживЊЕФЛЏЙЄдСЯЃЌвЛжжРћгУЕЭЦЗЮЛЭПѓ![]() жївЊКЌгаCu2SЁЂCuSЁЂFeOЁЂFe2O3ЁЂSiO2ЕШ
жївЊКЌгаCu2SЁЂCuSЁЂFeOЁЂFe2O3ЁЂSiO2ЕШ![]() ЮЊдСЯжЦШЁCuClЕФЙЄвеСїГЬШчЯТЃК
ЮЊдСЯжЦШЁCuClЕФЙЄвеСїГЬШчЯТЃК
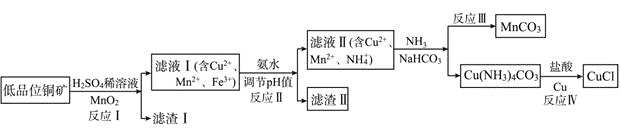
(1)ЗДгІЂёЁАНўШЁЁБЧАашНЋЭПѓЗлЫщЕФФПЕФЪЧ___________________________ЃЛ
(2)ТЫдќЂёЕФГЩЗжГ§SКЭ![]() ЭтЛЙКЌга___________ЃЌЗДгІ Ђёжа
ЭтЛЙКЌга___________ЃЌЗДгІ Ђёжа![]() ЕФзїгУЮЊ_______________
ЕФзїгУЮЊ_______________
(3)вбжЊЩњГЩЧтбѕЛЏЮяЕФpHШчЯТБэЃЌдђЗДгІЂђЁАжаКЭЁБЪБЃЌгУАБЫЎЕїpHЕФЗЖЮЇЪЧ______________ЁЃ
ЮяжЪ |
|
|
|
ПЊЪМГСЕэpH |
|
|
|
ЭъШЋГСЕэpH |
|
|
|
(4)МьбщТЫвКЂђжаЪЧЗёКЌга![]() ЫљашвЊЕФЪдМСЪЧЃК______________
ЫљашвЊЕФЪдМСЪЧЃК______________
(5)ЂйЗДгІЂѓжаЩњГЩФбШм![]() ЕФРызгЗНГЬЪНЃК______________
ЕФРызгЗНГЬЪНЃК______________
ЂкЗДгІЂєЫљЖдгІЕФЛЏбЇЗНГЬЪНЃК______________________________
(6) CuClЕФЖЈСПЗжЮі
ВНжш1.ШЁбљЦЗ0.7500gКЭ30.0mL 1.0molЁЄLЃ1Й§СПЕФFeCl3ШмвКжУгк250mLЕФзЖаЮЦПжаЃЌВЛЖЯвЁЖЏЁЃ
ВНжш2.Д§бљЦЗШмНтКѓЃЌЦНОљЗжЮЊ3ЗнЃЌгУ0.1000molЁЄLЃ1 Ce(SO4)2БъзМШмвКНјааЕЮЖЈЁЃ
Ш§ДЮЪЕбщВтЕУЪ§ОнШчЯТБэ
ађКХ | 1 | 2 | 3 |
Ц№ЪМЖСЪ§ |
|
|
|
жеЕуЖСЪ§ |
|
|
|
вбжЊЃК![]() ЃЛ
ЃЛ![]() ЁЃ
ЁЃ
ЂйЪ§ОнДІРэЃКМЦЫуЕУCuClЕФДПЖШЮЊ_________![]()
ЂкЮѓВюЯТСаВйзїЛсЪЙВтЖЈНсЙћЦЋИпЕФЪЧ______________
A.зЖаЮЦПжагаЩйСПеєСѓЫЎ
B.ЕЮЖЈжеЕуЖСЪ§ЪБбіЪгЕЮЖЈЙмПЬЖШЯп
C.0.1000molЁЄLЃ1СђЫсюцШмвКОУжУКѓХЈЖШБфаЁ
D.ЕЮЖЈЧАЕЮЖЈЙмМтзьЮоЦјХнЃЌЕЮЖЈКѓВњЩњЦјХн
E.гУСПЭВШЁ10.0mL 1.0molЁЄLЃ1ЕФ![]() ШмвКЪБбіЪгПЬЖШЯп
ШмвКЪБбіЪгПЬЖШЯп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиОЇЬхЕФа№ЪіжаЃЌДэЮѓЕФЪЧ
A.ТШЛЏФЦОЇЬхжаЃЌУПИіNa+жмЮЇОрРыЯрЕШЧвзюНќЕФNa+ЙВга6Иі
B.Н№ЪєОЇЬхжаЃЌвдЁАЁABCABCABCЁЁБаЮЪНЕФЖбЛ§ГЦЮЊУцаФСЂЗНЖбЛ§
C.ИЩБљОЇЬхжаЃЌУПИіCO2ЗжзгжмЮЇОрРыЯрЕШЧвзюНќЕФCO2ЗжзгЙВга12Иі
D.Н№ИеЪЏЭјзДНсЙЙжаЃЌгЩЙВМлМќаЮГЩЕФЬМдзгЛЗжаЃЌзюаЁЕФЛЗЩЯга6ИіЬМдзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A.4CuOЃЈsЃЉ=2Cu2OЃЈsЃЉ+O2ЃЈgЃЉдкЪвЮТЯТВЛФмздЗЂНјааЃЌЫЕУїИУЗДгІЁїH>0
B.ЯђЯЁДзЫсжаМгШыДзЫсФЦЙЬЬхЃЌШмвКpHЩ§ИпЕФжївЊдвђЪЧДзЫсФЦЫЎНтГЪМюад
C.ЪвЮТЯТKЃЈHCNЃЉ<KЃЈCH3COOHЃЉЃЌЫЕУїCH3COOHЕФЕчРыЖШвЛЖЈБШHCNДѓ
D.H2SЃЈgЃЉ+FeOЃЈsЃЉ![]() FeSЃЈsЃЉ+H2OЃЈgЃЉЃЌЦфЫћЬѕМўВЛБфЪБдіДѓбЙЧПЃЌЗДгІЫйТЪVе§ЃЈH2SЃЉКЭH2SЕФЦНКтзЊЛЏТЪОљдіДѓ
FeSЃЈsЃЉ+H2OЃЈgЃЉЃЌЦфЫћЬѕМўВЛБфЪБдіДѓбЙЧПЃЌЗДгІЫйТЪVе§ЃЈH2SЃЉКЭH2SЕФЦНКтзЊЛЏТЪОљдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщЮѓВюЗжЮіДэЮѓЕФЪЧЃЈ ЃЉ
A. гУЪЊШѓЕФpHЪджНВтЯЁМювКЕФpHЃЌВтЖЈжЕЦЋаЁ
B. гУШнСПЦПХфжЦШмвКЃЌЖЈШнЪБИЉЪгПЬЖШЯпЃЌЫљХфШмвКХЈЖШЦЋаЁ
C. ЕЮЖЈЧАЕЮЖЈЙмФкЮоЦјХнЃЌжеЕуЖСЪ§ЪБгаЦјХнЃЌЫљВтЬхЛ§ЦЋаЁ
D. ВтЖЈжаКЭЗДгІЗДЕФгІШШЪБЃЌНЋМюЛКТ§ЕЙШыЫсжаЃЌЫљВтЮТЖШжЕЦЋаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкИїЪЕбщзАжУЭМЕФа№ЪіжаЃЌе§ШЗЕФЪЧ( )
A.зАжУ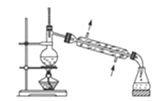 ГЃгУгкЗжРыЛЅВЛЯрШмЕФвКЬхЛьКЯЮя
ГЃгУгкЗжРыЛЅВЛЯрШмЕФвКЬхЛьКЯЮя
B.зАжУ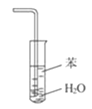 ПЩгУгкЮќЪеNH3ЃЌВЂЗРжЙЕЙЮќ
ПЩгУгкЮќЪеNH3ЃЌВЂЗРжЙЕЙЮќ
C.ЭМ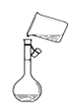 ЪЧНЋШмНтКУЕФШмвКзЊвЦЕНШнСПЦПжа
ЪЧНЋШмНтКУЕФШмвКзЊвЦЕНШнСПЦПжа
D.ЭМ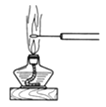 ПЩЙлВьNaClЕФбцЩЋЗДгІ
ПЩЙлВьNaClЕФбцЩЋЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.ЧтЦјЕФШМЩеШШЮЊ285 . 5KJ/mol ЃЌдђЕчНтЫЎЕФШШЛЏбЇЗНГЬЪНЮЊ2H2O(l)![]() 2H2(g)+O2(g) ЁїH=+285.5kJ/mol
2H2(g)+O2(g) ЁїH=+285.5kJ/mol
B.вбжЊH+(aq)+OH-(aq)=H2O(l) ЁїH= -57.3 kJ/molЃЌдђЯЁH2SO4ШмвККЭЯЁBa(OH)2ШмвКЗДгІЕФЗДгІШШЁїH=2 ЁС(-57.3) kJ/mol
C.дкCO2жаЃЌMgШМЩеЩњГЩMgOКЭCЃЌИУЗДгІжаЛЏбЇФмШЋЖМзЊЛЏЮЊШШФм
D.вбжЊAX3ЕФШлЕуКЭЗаЕуЗжБ№ЮЊвЛ93 .6ЁцКЭ76ЁцЃЌ AX5ЕФШлЕуЮЊ167ЁцЁЃЪвЮТЪБAX3гыЦјЬхX2ЗДгІЩњГЩ1 mol AX5ЃЌЗХГіШШСП123.8 KJ/molЁЃИУЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊAX3(l)+ X2(g)= AX5(s) ЁїH= вЛ123.8 kJ/mol
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com