
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D. P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】2015年9月1日,四川最长寿老人付素清迎来118岁生日。有科学家对其身体基因进行检测后,发现她的钙磷代谢调解能力、叶酸利用能力都非常好,不容易骨折,患心血管疾病的几率也很低,超过一半的中国人,脂质代谢能力都不如付素清。请结合材料回答下列问题:
(1)脂质是细胞中重要的化合物,其中, 是最常见的脂质,也是细胞内良好的储能物质,除此之外,还具有 、 和___________的功能。而其中的 是构成细胞膜的重要成分。
(2)饮食中过多的摄入 ,会在血管壁上形成沉积,造成血管堵塞。
(3)脂质与多糖、蛋白质、核酸都是细胞中重要的有机化合物,其中后三者是生物大分子,生物大分子以 为骨架,它们都是由许多基本的组成单位连接而成,这些基本的单位称为单体。
(4)组成蛋白质的单体的分子结构通式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备,不符合工业生产实际的是( )
A.电解熔融氯化镁制单质镁
B.用软锰矿和浓盐酸在加热条件下制氯气
C.用二氧化硅在高温下与焦炭反应制得粗硅
D.工业上炼铁时,常用石灰石除去铁矿石中的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的加工说法正确的是( )
A.石油裂解气和水煤气的主要成分都是甲烷
B.石油分馏是化学变化,可得到汽油、煤油
C.化石燃料所存贮的大量能量,实质是来源于太阳能
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知:![]()
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是 ( )
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ
C.相同条件下,1 mol H2(g)和1 mol I2(g)总能量小于2 mol HI(g)的总能量
D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用化学杂志曾报道,有一种功能高分子材料为聚乙交酯纤维材料C,用这种功能高分子材料制成的手术缝合线比天然高分子材料的肠线好。它的合成过程如下:
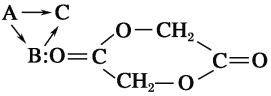
B是A合成C的中间体,它是由两分子A脱去两分子水形成的。
(1)写出由A合成C的化学方程式:____________________。
(2)写出由A制取B的化学方程式:____________________。
(3)医用高分子材料应具备哪些特性?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( ) 
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.T的最高价氧化物对应的水化物不能和强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气
体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是( )
A.PH=7时,溶液中c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C.当V(NaOH)=30mL时,溶液中 c(SO42﹣)+c(H+)=c(NH3H2O)+c(OH﹣)
D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42﹣浓度之和始终为0.1 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核磁共振谱(NMR)是研究有机化合物结构的有力手段之一,在所研究化合物的分子中,每一结构中的等性氢原子,在NMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的氢原子数成正比。例如,乙醛的结构式为 ,其NMR中有两个峰,强度之比为3∶1。
,其NMR中有两个峰,强度之比为3∶1。
(1)结构简式为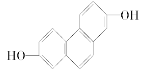 的有机物,在NMR上观察峰的强度之比为________________。
的有机物,在NMR上观察峰的强度之比为________________。
(2)实践中可根据NMR上观察到的氢原子给出的峰值情况,确定有机物的结构。如分子式为C3H6O2的链状有机物,其NMR上峰给出的稳定强度仅有4种,它们分别为:①3∶3;②3∶2∶1;③3∶1∶1∶1;④2∶2∶1∶1,请分别推断出其对应的全部结构:
①________________________________,
②________________________________,
③________________________________,
④________________________________。
(3)测得化合物CH3CH2CH2CH3的NMR上可观察到两种峰,而测得CHCH3CHCH3时,却得到氢原子给出的信号峰4个,结合其空间结构解释产生4个信号峰的原因:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com