
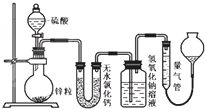
 不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).| m |
| 32 |
| m |
| 64 |
| m |
| 32 |
| m |
| 32 |
| m |
| 32 |
| m |
| 64 |
| m |
| 32 |
| m |
| 64 |
| m |
| 64 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4gCu与足量硫完全反应,转移的电子数为0.1NA |
| B、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
| C、分离Na2CO3溶液和CH3COOC2H5常用蒸馏法 |
| D、将H2S通入FeCl3溶液中会产生淡黄色沉淀,继续通入则会产生黑色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
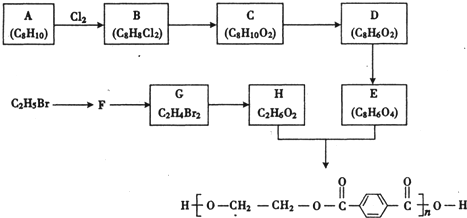
| 试剂a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol?L-1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石蕊层仍为紫色,有机层无色 |
| B、石蕊层为三层环,由上而下是红、紫、红 |
| C、石蕊层有两层,上层为紫色,下层为蓝色 |
| D、石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
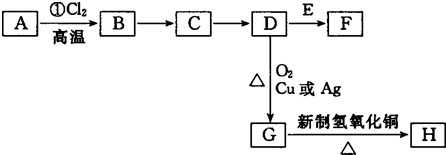
| 高温 |
| 氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在配制牛肉膏蛋白胨固体培养基时,需加入琼脂,不需要添加NaCl |
| B、利用DNA在不同浓度的NaCl溶液中的溶解度不同,粗提取DNA |
| C、在腐乳制作过程中,装瓶时需逐层等量加入NaCl,以防杂菌污染 |
| D、将哺乳动物的成熟红细胞浸泡于0.9%的NaCl溶液中,用以制备纯净的细胞膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com