
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
分析 (1)二氧化硫形成硫酸型酸雨的过程为二氧化硫与水反应生成亚硫酸,亚硫酸再被氧化成硫酸,合并过程写出化学方程式;
(2)二氧化硫为酸性气体,与氢氧化钠反应生成亚硫酸钠和水;
(3)①根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性,由表格数据知,随n(HSO3-)的增大,溶液酸性增强,即HSO3-的电离程度大于水解程度,亚硫酸氢钠溶液呈酸性;
②根据溶液中电荷守恒和物料守恒确定溶液中各种离子浓度的关系;
(4)如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡.
解答 解:(1)SO2形成硫酸型酸雨的反应:2SO2+O2+2 H2O=2H2SO4,
故答案为:2SO2+O2+2H2O=2H2SO4;
(2)二氧化硫与氢氧化钠反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
(3)①在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;亚硫酸氢钠溶液中存在HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
故答案为:酸;HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.
a、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故a正确;
b、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;
c、溶液呈中性时,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误;
故选:ab.
故答案为:ab;
(4)A、滴入酚酞试液变红,说明亚硫酸钠溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性,酚酞在pH大于8时,呈红色,加入硫酸溶液后,溶液褪色,溶液可能呈酸性越可能呈碱性,若为酸性,不能说明平衡移动,故A错误;
B、滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,氯水具有强氧化性,具有漂白性,再加入氯水后溶液褪色,不能说明存在水解平衡,故B错误;
C、滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和亚硫酸氢根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,所以说明存在水解平衡,故C正确;
故答案为:C.
点评 本题为综合题,考查了离子方程式、化学方程式和离子浓度大小的比较等知识点,题目难度中等,比较溶液中各种离子浓度相对大小时要结合电荷守恒和物料守恒分析解答,此点是学习的难点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 称取3.84g CuSO4粉末,加入250mL水 | |
| B. | 称取6.25g CuSO4•5H2O晶体,加水配成250mL溶液 | |
| C. | 称取4.0g CuSO4粉末,加入250mL水 | |
| D. | 称取4.0g CuSO4•5H2O晶体,加水配成250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. | 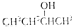 的命名为2-甲基-1-丙醇 的命名为2-甲基-1-丙醇 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | CH2═CH2+HBr-→CH3-CH2Br | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 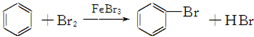 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X3Y2 | B. | X2Y | C. | XY2 | D. | XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的NaHCO3和Na2CO3固体中,分别加入足量盐酸,NaHCO3产生的 气体多 | |
| B. | 过量的铁与硝酸反应生成硝酸亚铁,过量的铁与氯气反应也生成氯化亚铁 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水现酸性,向其中滴加几滴紫色石蕊试液,充分振荡后,溶液最终呈红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com