
【题目】在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于QkJ
【答案】D
【解析】A、根据反应在恒温恒压条件下进行分析;B、根据化学反应速率的概念分析计算;C、绝热条件温度升高平衡逆向进行;D、恒温恒容条件反应过程中,压强减小。
详解:A、反应在恒温恒压条件下进行,应前后的压强之比为1:1,故A错误;
B、若容器体积不变, v(SO3)=![]() =0.35mol·L-1·min-1,但反应是在恒温恒压条件进行,反应达到平衡时,容器体积小于2L,相等于增大体系压强,化学反应速率增大,所以v(SO3)>0.35mol·L-1·min-1,故B错误;
=0.35mol·L-1·min-1,但反应是在恒温恒压条件进行,反应达到平衡时,容器体积小于2L,相等于增大体系压强,化学反应速率增大,所以v(SO3)>0.35mol·L-1·min-1,故B错误;
C、若把“恒温恒压下”改为“恒压绝热条件下”反应,由于该反应的正反应是放热反应,绝热温度升高,平衡逆向进行,平衡后n(SO3)<1.4mol,所以C选项是错误的;
D、若把“恒温恒压下”改为“恒温恒容下”反应,反应过程中压强减小,平衡逆向进行,达平衡时放出热量小于QkJ,故D正确。
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为______________(用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素(-1价)最终氧化成SO42-,写出制备二氧化氯的离子方程式_____________________________________。
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。

生产漂白粉反应的化学方程式为_____________________。实际生产中,将石灰乳(含有3%-6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_____________________________。
(4)用莫尔法可以测定溶液中Cl-的含量。莫尔法是一种沉淀滴定法,用标准AgNO3溶液滴定待测液,以K2CrO4为指示剂,滴定终点的现象是溶液中出现砖红色沉淀(Ag2CrO4)。已知平衡Cr2O72-+H2O![]() 2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。
(1)写出反应的热化学方程式。
(2)已知H2O(l)转化为H2O(g)的△H=44kJ·mol-1,试计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
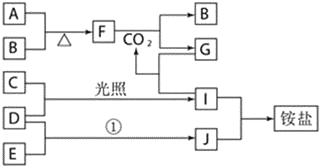
请回答下列问题:
(1)写出物质F的名称__________,物质E的电子式__________。
(2)写出下列物质之间反应的化学方程式:
①F和CO2___________;
②D和E_______________,它________(填“是”或“不是” )可逆反应。
(3)物质G的化学式为______,写出它与I反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体X置于密闭容器中,在一定温度下发生下列反应:①X(s)![]() Y(g)+Z(g);②2Z(g)
Y(g)+Z(g);②2Z(g) ![]() W(g)+G(g)。达到平衡时,c(W)=0.25mol/L,c(Z)=4mol/L,则此温度下反应①的平衡常数值为
W(g)+G(g)。达到平衡时,c(W)=0.25mol/L,c(Z)=4mol/L,则此温度下反应①的平衡常数值为
A. 9 B. 16 C. 18 D. 24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年5月12日,四川汶川发生8.0级大地震,地震造成汶川地区的水体污染。水处理包含水的净化与消毒,以下可以用于饮用水净化处理的试剂是( )
A.石灰水[Ca(OH)2]B.盐酸
C.明矾[KAl(SO4)212H2O]D.纯碱(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器中,可直接用酒精灯加热的是( )
①烧杯;②坩埚;③锥形瓶;④蒸发皿;⑤试管;⑥圆底烧瓶;⑦容量瓶
A. ②④⑤ B. ①②⑤⑥ C. ②④⑥⑦ D. ①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH的变化的曲线是_______。

(2)用H2表示从0~2s内该反应的平均速率v(H2)=___________________。
(3)该反应达到最大限度时CO的转化率为___________。
(提示:转化率=![]() ×100%)
×100%)
(4)能说明该反应已达到平衡状态的是______。
a. CO与H2的浓度保持不变 b. 容器内密度保持不变
c. 容器内压强保持不变 d. 每消耗1molCH3OH的同时有2mol H–H形成
(5)CH3OH与O2的反应可将化学能转化为电能,其工作原理如下图所示,图中CH3OH从______(填A或B)通入。
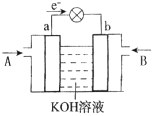
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com