
下列药品和装置合理且能完成相应实验的是
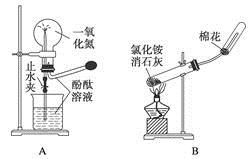
A.喷泉实验
B.实验室制取并收集氨气
C.制备氢氧化亚铁
D.验证苯中是否有碳碳双键
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:简答题
碳和碳的化合物广泛的存 在于我们的生活中。
在于我们的生活中。
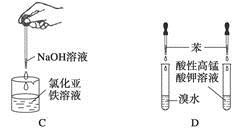
(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g) △H= 。
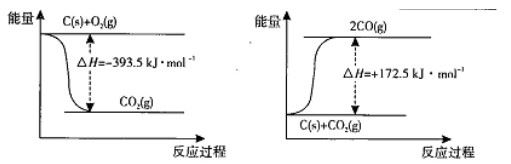

(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H2,一定
条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如右图所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3) CO2溶于水生成碳酸。已知下列数据:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数( 25℃) | Ka1= Ka2= 5.61× 10一11 | Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知:NH4+水解的平衡常数Kh=Kw/Kb,
CO32-第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中CO32-
发生第一步水解的离子方程式 。
②下列粒子之间的关系式,其中正确的是 。
A.c(NH4+)>c(HCO3-)> c(CO32-)>(NH4+)
B.c(NH4+)+c(H+)= c(HCO3-)+c(OH-)+ c(CO32-)
C. c(CO32-)+ c(HCO3-)+c(H2CO3)=1mol/L
D. c(NH4+)+ c(NH3.H2O)=2 c(CO32-)+ 2c(HCO3-) +2c(H2CO3)
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特
殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
某温度时,在密闭容器中X、Y、Z三种气体浓度的变化如图甲所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图乙所示。则下列结论正确的是
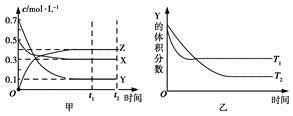
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:推断题
弹性涤纶是一种新型聚酯纤维,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
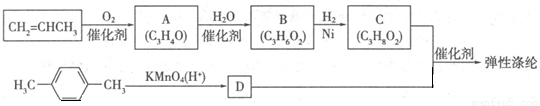
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,B中所含官能团的名称为 。
(2)由物质C与D反应生成弹性涤纶的化学方程式为 。
(3)由物质B到C的化学反应类型为 。
(4)写出C与足量钠反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
实验:①向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,得到浊液a,过滤得到滤液b和白色沉淀c。②向沉淀c中滴加0.1mol/LFeCl3溶液,沉淀变为红褐色。下列分析不正确的是
A、浊液a中存在沉淀溶解平衡:Mg (OH) 2(s) Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
B、滤液b中不含有Mg2+
C、②中颜色变化说明Mg (OH)2转化为Fe(OH)3
D、实验可以证明Fe(OH)3比Mg (OH)2更难溶
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
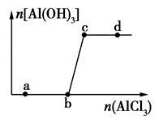
A.a点对应的溶液中:Na+、Fe3+、SO42- 、HCO3-
B.b点对应的溶液中:Ag+、Ca2+、NO3- 、F-
C.c点对应的溶液中:Na+、S2-、SO42- 、Cl-
D.d点对应的溶液中:K+、NH4+ 、I-、 CO32-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:推断题
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:
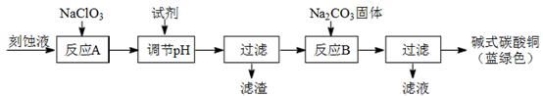
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
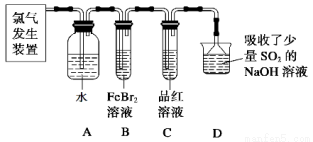
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是 。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
关于下列各实验装置的叙述中,不正确的是
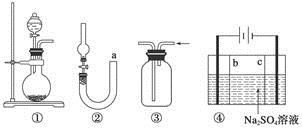
A.装置①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验装置②的气密性
C.实验室可用装置③收集H2、NH3
D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
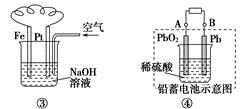
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
有关下列装置的叙述不正确的是
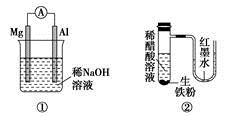
A.图①铝片发生的电极反应式是:Al+4OH--3e-===AlO2-+2H2O
B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+===Fe2++H2↑
C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.图④充电时,阳极反应是:PbSO4+2H2O-2e-===PbO2+SO42-+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com