


分析 腐蚀废液中加入过量的铁粉,三价铁离子与铁反应生成二价铁离子,铜离子与铁反应生成铜和二价铁离子,搅拌过滤得到固体铜和过量的铁粉,滤液为氯化亚铁溶液,向滤渣中加入足量盐酸或稀硫酸溶解铁粉过滤得到纯净的铜,向氯化亚铁溶液中通入氯气反应生成氯化铁,
(1)铜与盐酸不反应,铁粉与盐酸反应生成氯化亚铁;亚铁离子具有还原性,据此解答即可;
(2)依据化学反应方程式判断即可;根据Cl2与FeCl2反应生成FeCl3,考虑尾气吸收画出图即可;
(3)根据铁与CuCl2、FeCl3、HCl反应求出参加反应的铁粉的质量;根据Cl2与FeCl2反应生成FeCl3计算出Cl2的物质的量.
解答 解:(1)铜与盐酸不反应,铁粉与盐酸反应生成氯化亚铁,所以加入盐酸可以除去铜中的铁粉,亚铁离子具有还原性,能与高锰酸钾溶液反应使其褪色,故答案为:稀盐酸;取少量腐蚀液,滴加KMnO4溶液,KMnO4溶液褪色;
(2)二氧化锰与浓盐酸反应生成氯化锰和氯气,其中氯化锰中的氯离子来源于稀盐酸,此时盐酸体现酸性,生成氯气,表现盐酸的还原性,离子反应方程式为:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O,Cl2与FeCl2反应生成FeCl3,用氢氧化钠溶液尾气要吸收,装置为 ;
;
故答案为:2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O;酸性和还原性;  ;
;
(3)Fe+CuCl2 =FeCl2 +Cu
0.3mol 1.5mol•L-1×0.2L 0.3mol
Fe+2FeCl3 =3FeCl2
0.1mol 1.0mol•L-1×0.2L 0.3mol
Fe+2HCl=FeCl2 +H2↑
0.3mol 3.0mol•L-1×0.2L 0.3mol
共消耗Fe粉的物质的量为0.7mol,生成FeCl2的物质的量为 0.9mol,原溶液中含有FeCl2=3.0mol•L-1×0.2L=0.6mol
Fe粉的质量为0.7mol×56g/mol=39.2g,
Cl2+2FeCl2 =2FeCl3
0.75mol 1.5mol
故答案为:39.2;0.75.
点评 本题主要考查了学生铁及化合物的性质,要求学生具有分析和解决问题的能力,难度不大.


科目:高中化学 来源: 题型:填空题
 (1)如图为金刚烧的空间结构(碳架)
(1)如图为金刚烧的空间结构(碳架)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
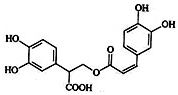 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图. | A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生加成反应、取代反应和酯化反应 | |
| D. | 迷迭香酸的化学式为C18H18O8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
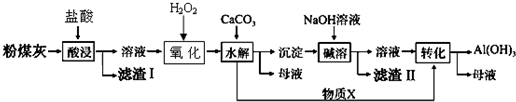
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 工作时,电解质溶液中K+向负极移动 | |
| B. | 电路若有0.4mol电子通过,则消耗O2的量为0.2mol | |
| C. | 一段时间后溶液中OH-浓度将升高 | |
| D. | 正极反应式为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | NaI | C. | NaOH | D. | AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com