

分析 废铁屑(含少量氧化铝、氧化铁等)加入稀硫酸溶液溶解,得到的溶液含有硫酸亚铁、硫酸铝,加入碳酸氢钠搅拌,沉淀铝离子,过滤得硫酸亚铁溶液,向所得FeSO4溶液中加入少量3moL•L-1H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O],
(1)加入少量NaHCO3,沉淀铝离子;
(2)硫酸亚铁溶液在空气中久置,亚铁离子被氧气氧化为铁离子;
(3)①KMnO4与(NH4)2Fe(SO4)2溶液反应中,Mn元素的化合价降低5,Fe元素的化合价升高,升高1,结合电子、电荷及原子守恒配平;
②由题可知Cu2S和CuS的混合物与KMnO4溶液反应有二氧化硫气体生成,SO2与酸性KMnO4溶液反应,测出的数据不准确;
③根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的物质的量浓度,再根据配制过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积;
④根据金属化合物的质量和金属化合物与高锰酸钾反应的高锰酸钾的物质的量列方程式组,计算出硫化铜的质量,再根据质量分数计算方法计算即可.
解答 解:(1)加入少量NaHCO3,与促进铝离子水解生成沉淀,除去铝离子,而不使亚铁离子形成沉淀;
故答案为:除去铝离子,而不使亚铁离子形成沉淀;
(2)硫酸亚铁溶液在空气中久置,亚铁离子被氧气氧化为铁离子,离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(3)①Mn元素的化合价由+7降到+2,降低5价;Fe元素的化合价由+2升高到+3价,升高1价,最小公倍数为5;再根据质量守恒得到H2O的系数为4,H+的系数为8,离子反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:1、5、8、1、5、4;
②二氧化硫具有还原性,高锰酸钾具有强氧化性,Cu2S和CuS的混合物在酸性溶液中用溶液处理后,溶液若不煮沸,则溶液中的SO2与KMnO4溶液反应5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,无法准确测定混合物中CuS的质量分数;
故答案为:若不煮沸赶尽SO2,溶液中的SO2与KMnO4溶液反应,无法准确测定混合物中CuS的质量分数;
③分数为98%、密度为1.84g•cm-3的浓硫酸的浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
配制过程中硫酸的物质的量不变,则需要该浓硫酸的体积为:$\frac{3mol/L×0.5L}{18.4}$≈0.0815L=81.5mL;
故答案为:81.5;
④电子守恒有:MnO4-~5 Fe2+,剩余的KMnO4的物质的量为:50.00×10-3L×0.2 mol•L-1×1/5=2.00×10-3 mol,
用0.150 mol•L-1 KMnO4溶液处理Cu2S和CuS的混合物时,反应的KMnO4的物质的量为:40 mL×10-3L×0.150 mol•L-1-2.00×10-3 mol=4.00×10-3 mol,
设:Cu2S和CuS的混合物中,Cu2S的物质的量为x,CuS的物质的量为y
160g/mmol x+96 g/mmoly=0.352g
8/5 x+6/5y=4.00×10-3 mol
解方程组得x=1.00×10-3 mol y=2.00×10-3 mol
混合物中CuS的质量分数为:m(CuS)/m(总)=(2.00×10-3 mol×96 g/mmol)/0.352g=54.5%;
答:混合物中CuS的质量分数54.5%.
点评 本题考查了物质的制备,侧重考查氧化还原反应的有关计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应计算及转移电子的考查,注意从化合价角度分析,题目难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ•mol-1,则表示H2燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 中和热为57.3 kJ•mol-1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知:C(s,金刚石)+O2(g)═CO2(g)△H=-395.4 kJ•mol-1,C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 | |
| D. | 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46 gNO2与N2O4的混合气体中含有的分子总数为NA | |
| B. | 常温常压下,将0.1molFe投人足量的浓硝酸中,转移的电子数为0.3NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
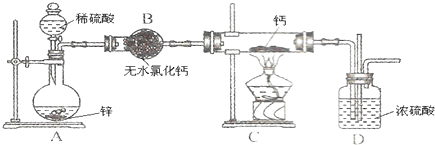
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
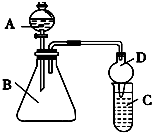 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
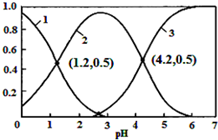 已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )| A. | pH=1.2溶液中:c(Na+)+c(H+)═c(OH-)+c(H2SO3) | |
| B. | 常温下,$\frac{{c}^{2}(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})•c(S{{O}_{3}}^{2-})}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小 | |
| D. | 曲线3表示的微粒是SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
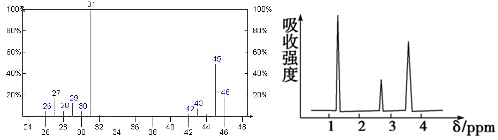
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同 | |
| C. | 纯碱是属于碱类、谷氨酸一钠(C5H8NO4Na,味精)属于盐类 | |
| D. | 压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的清洁燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com